Ингибиторы холинэстеразы побочные действия
Как известно, в нервной системе имеется множество синапсов. Они необходимы для передачи импульсов. В этом процессе участвуют несколько видов медиаторов. Среди них – ацетилхолин, норадреналин, ГАМК, серотонин и т. д. Медиаторы (трансмиттеры) необходимы для осуществления передачи сигналов между нейронами. Кроме того, благодаря им осуществляется возбуждение или торможение мускулатуры. При различных патологиях нервной системы работа нейротрансмиттеров может нарушаться. Это случается вследствие атрофических и дегенеративных процессов в головном мозге. В этих случаях применяют препараты, необходимые для усиления или ослабления передачи сигналов. К подобной фармакологической группе относятся ингибиторы холинэстеразы. Они применяются при миастении, невритах, амиотрофическом склерозе, болезни Альцгеймера, психических патологиях.
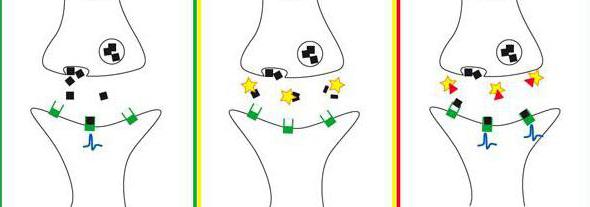
Действие ингибиторов холинэстеразы
Ингибиторы холинэстеразы – это медицинские препараты, которые широко используются в неврологии и психиатрии. Они подразделяются на несколько групп, каждая из которых применяется в конкретном случае. Действие этих медикаментов основано на блокировании холинэстеразы. Данный фермент имеется как у здоровых людей, так и у страдающих различными заболеваниями. Он необходим для расщепления нейромедиатора – ацетилхолина. В результате его действия трансмиттер разрушается до холина и уксусной кислоты. При различных патологиях головного мозга происходит постепенная атрофия коры. В результате некоторые структуры могут полностью разрушиться, в том числе и холинэргическая система. Помимо атрофии головного мозга, к этому приводят дегенеративные процессы аутоиммунной, инфекционной, вирусной природы. Из-за разрушения ядер переднего мозга наблюдается выраженный недостаток нейромедиатора – ацетилхолина. Чтобы как можно дольше не было дефицита данного вещества, необходимо воздействовать на фермент, разрушающий его. С этой целью применяют ингибиторы холинэстеразы. Благодаря им активность нейротрансмиттера может сохраняться в течение нескольких лет.

Ингибиторы холинэстеразы: классификация препаратов
Существует несколько видов антихолинэстеразных препаратов. Их классифицируют по фармакологическому воздействию на фермент. Некоторые из них блокируют холинэстеразу необратимо, другие – временно. Выделяют 3 группы медикаментов. Среди них:
- Обратимые блокаторы. Эти ингибиторы холинэстеразы воздействуют на постсинаптическую передачу сигнала. Благодаря им действие фермента временно прерывается. К данной группе относят акридины и пипередины.
- Псевдонеобратимые блокаторы холинэстеразы. Механизм их действия заключается в соединении с онионовой частью молекулы фермента. Помимо этого, они способны связываться с рецепторами ацетилхолина. Подобными свойствами обладает группа карбаматов.
- Необратимые ингибиторы холинэстеразы. Препараты этой группы называются фосфороорганическими средствами. Представителем является медикамент «Метрифонат».
К группе акридинов относятся препараты «Такрил» и «Велнакрин». Представители карбаматов — медикаменты «Ривастигмин», «Эпистатигмин».
Показания к применению ингибиторов холинэстеразы
Ингибиторы холинэстеразы используются для лечения мышечных заболеваний центрального генеза, атрофических и дегенеративных патологий мозга. Кроме того, некоторые медикаменты выпускаются в виде капель. Их применяют при повышенном внутриглазном давлении – глаукоме. Препараты, которые ингибируют холинэстеразу обратимо, назначают для лечения деменции, болезни Пика и Альцгеймера. Предпочтение стоит отдать группе пиперединов, так как они действуют избирательно и имеют меньше побочных эффектов. В последнее время показания к применению медикаментов расширились. Это связано с более детальным изучением их свойств. К болезням, при которых назначают антихолинэстеразные препараты, относят миастению, атонию кишечника, мышечную дистрофию, боковой амиотрофический склероз, паралич конечностей дегенеративного происхождения. Необратимые ингибиторы применяют при отравлениях.

Противопоказания к использованию антихолинэстеразных препаратов
Медикаменты, относящиеся к этой группе, не применяют при судорожном синдроме, гиперкинезах любой этиологии. Также они противопоказаны пациентам, страдающим тяжелой сердечной недостаточностью, бронхиальной астмой, тиреотоксикозом. Нежелательно принимать антихолинэстеразные средства при сопутствующей язвенной болезни желудка, энтерите. Медикаменты не показаны беременным и кормящим женщинам.
Ингибиторы холинэстеразы: препараты выбора при болезни Альцгеймера
Болезнь Альцгеймера – это атрофическое поражение ЦНС, при котором наблюдается амнезия, расстройство личности и деменция. Учёные всего мира пытаются найти лекарство от этой патологии. При легкой и средней выраженности заболевания препаратом выбора является «Донепезил». Он относится к обратимым ингибиторам холинэстеразы, обладает избирательным эффектом. Медикамент применяют с целью патогенетической терапии. Он не способен полностью излечить пациента, но замедляет развитие симптомов болезни Альцгеймера.
Входит в группу:
11.08.02 —
Препараты, повышающие тонус и моторику ЖКТ
Аксамон® | Р-р д/в/м и п/к введения 5 мг/мл: амп. 1 мл 10 шт. рег. №: ЛП-002247 Дата перерегистрации: 26.09.18 Р-р д/в/м и п/к введения 15 мг/мл: амп. 1 мл 10 шт. рег. №: ЛП-002247 Дата перерегистрации: 26.09.18 | ПИК-ФАРМА (Россия) Произведено: ЭЛЛАРА (Россия) контакты: (Россия) | |
Ипигрикс® | Таб. 20 мг: 50 шт. рег. №: ЛП-003193 Дата перерегистрации: 19.11.18 | ГРИНДЕКС (Латвия) контакты: (Латвия) | |
Ипидакрин | Р-р д/в/м и п/к введения 5 мг/мл: 1 мл амп. рег. №: ЛП-005851 Р-р д/в/м и п/к введения 15 мг/мл: 1 мл амп. рег. №: ЛП-005851 | БИННОФАРМ (Россия) | |
Нейромидин® | Таб. 20 мг: 50 шт. рег. №: П N014238/01 | OLAINFARM (Латвия) контакты: (Латвия) |
Нивалин® | Р-р д/инъекц. 1 мг/1 мл: амп. 10 или 100 шт. рег. №: П N008777 Р-р д/инъекц. 2.5 мг/1 мл: амп. 10 или 100 шт. рег. №: П N008777 Р-р д/инъекц. 5 мг/1 мл: амп. 10 или 100 шт. рег. №: П N008777 Р-р д/инъекц. 10 мг/1 мл: амп. 10 или 100 шт. рег. №: П N008777 | SOPHARMA (Болгария) контакты: (Россия) |
Описания препаратов с недействующими рег. уд. или не поставляемые на рынок РФ
Препараты для лечения деменции
Основные задачи лечения деменции:
- улучшение когнитивных функций
- поддержаник функциональной активности
- снижение выраженности поведенческих нарушений.
Выбор терапии зависит:
- от индивидуальных клинических симптомов каждого конкретного пациента
- от наличия сопутствующих заболеваний,
- от переносимости лекарственных средств и ряда других параметров.
Три группы лекарственных препаратов:
1 ГРУППА
Холинергические препараты — ингибиторы ацетилхолинэстеразы (АХЭ): ривастигмин, донепезил, галантамин
Ингибиторы холинэстераз предствляют собой группу препаратов, направленных на ингибирование ферментов, разрушающих ацетилхолин в синаптической щели. В соответствии с механизмами их действия различают 2 класса ингибиторов холинэстераз:
I класс — ингибиторы ацетилхолинэстеразы (реминил (галантамин), арисепт (донепезил)
II класс — ингибиторы ацетилхолинэстеразы и бутирилхолинэстеразы (экселон, ривастигмин)
2 ГРУППА
препараты, взаимодействующие с NMDA-рецепторами (мемантин)
3 ГРУППА
ноотропные препараты, нейропротекторные лекарственные средства, блокаторы кальциевых каналов, препараты, влияющие на амилоидогенез, иммуномодулирующие препараты и т.д.
В случае возникновения у больных эмоционально-аффективных и психотических реакций врач может назначить соответствующую сопутствующую терапию. При этом необходимо учитывать совместимость препаратов, а также вероятность развития нежелательных явлений.
Следует соблюдать осторожность при назначении нейролептиков (антипсихотиков) пациентам с деменцией, так как при деменции с тельцами Леви, которая имеет схожую клиническую картину с болезнью Альцгеймера, использование антипсихотиков противопоказано и может привести у ухудшению состояния.
Как лечат деменцию
Болезнь Альцгеймера и другие формы деменций на сегодняшний день относятся к неизлечимым заболеваниям. Но за последние десятилетия появление средств для медикаментозного лечения позволило облегчить тяжесть проявления основных симптомов деменции и отдалить наступление необратимого снижения на значительный период времени.
Препараты, доказавшие свою эффективность для лечения деменций
- препараты первого выбора — ингибиторы ацетилхолинэстеразы (активное вещество: ривастигмин или галантамин или донепезил). Рекомендованы для терапии всех стадий заболевания в руководствах по лечению деменции в Европе и США.
- препараты второго выбора — антагонисты NMDA-глутаматных рецепторов (активное вещество — мемантин). Они добавляются к препаратам первого выбора при снижении эффективности терапии или назначаются пациентам, которые поздно обращются к врачу (при средней и тяжелой стадии деменции)
О возможностях лечения для своего родственника проконсультируйтесь с вашим лечащим врачом или задайте вопрос нам через форму задать вопрос специалисту.
Важно помнить!
- чем раньше начато лечение, тем лучший результат может быть получен
- замедление течения болезни, достигнутое на фоне приема лекарств, означает, что многие функции мозга могут быть созхранены на более длительное время
- в результате своевременного и правильного лечения больной дольше сможет сохранить самостоятельность, лучше ориентироваться в быту, соответственно, нагрузка на родственников будет снижена
Дополнительные лекарственные препараты
На ранних этапах болезни могут возникнуть депрессии, беспокойства, возбудждение у пациента. При этих состояниях дополнительно назначают препараты:
- средства для улучшения настроения (антидепрессанты)
- средства для снятия беспокойства и возбуждения (нейролептики)
К дозированию этих препаратов нужно подходить очень осторожно, с учетом многих осложняющих факторов, свойственных пациентам пожилого возраста, таких как сахарный диабет, ревматизм, повышенное артериальное давление и другие заболевания сердечно-сосудистой системы.
Схема и дозировка должна быть согласована с вашим лечащим врачом!
Комментарии
Опубликовано в журнале:
«Фарматека», 2009, №15, с. 52-55
Е.А. Катунина, О.В. Аванесова, О.Р. Пестовская, Е.К. Абдрахманова, Ю.Н. Бездольный
Кафедра неврологии и нейрохирургии лечебного факультета РГМУ, Москва
Рассматриваются возможности применения ингибиторов ацетилхолинэстеразы, в первую очередь ипидакрина (Аксамона), при лечении заболеваний периферической нервной системы (различных моно- и полиневропатий, невралгий и др.). Подчеркивается, что включение ипидакрина в комплекс лечебных мероприятий при поражениях периферических нервов позволяет повысить результативность лечения, сократить сроки восстановительного периода и не сопровождается риском развития мышечных контрактур. Помимо положительного влияния на восстановление проведения импульса по периферическим нервам и процесс реиннервации ипидакрин обладает противоболевым эффектом. Хорошая переносимость препарата позволяет рекомендовать его широкому кругу пациентов, в т. ч. и пожилого возраста с сопутствующей патологией.
Ключевые слова: заболевания периферической нервной системы, невропатии, ингибиторы ацетилхолинэстеразы, ипидакрин
Поражения периферической нервной системы (ПНС) относятся к числу наиболее часто встречающихся заболеваний. Их распространенность, по данным ВОЗ, составляет от 8 до 10 % от общей заболеваемости, на их долю приходится до 50 % заболеваний нервной системы. Высокая частота заболеваний ПНС обусловлена тем, что входящие в ее состав структуры имеют большую протяженность, обычно лишены костной защиты и нередко подвергаются травматизации. Незащищенность ПНС гематоэнцефалическим барьером (ГЭБ) приводит к ее уязвимости при действии токсических и инфекционных агентов. Заболеваниям ПНС подвержены в основном люди трудоспособного возраста. Поэтому скорейшее восстановление нарушенных функций у таких больных является не только медицинской, но и социальной проблемой [8, 12].
К заболеваниям ПНС относят довольно большую группу патологий: фокальные невропатии, множественные невропатии, поли-, радикуло-, полирадикулоневропатии, невралгии. Этиологические факторы, вызывающие повреждение структур ПНС, можно разделить на воспалительные, токсико-аллергические, дисметаболические и травматические. Травматическое повреждение может возникать в результате воздействия внешних факторов или быть обусловленным эндогенными причинами, например сдавлением нерва мышцами, связками, остеофитами (компрессионно-ишемические невропатии). К той же группе можно отнести и повреждения нервных корешков межпозвоночными дисками или костными разрастаниями (радикулоишемии).
Патогенетические факторы могут приводить к валлеровскому перерождению – дегенерации нерва ниже его пересечения, преимущественному повреждению аксона (аксонопатиям) или миелиновой оболочки (миелинопатиям), сочетанному повреждению аксона и миелиновой оболочки (аксономиелинопатиям).
Аксонопатии обычно возникают при токсических и дисметаболических процессах (сахарный диабет, алкоголизм, заболевания печени и почек, дефицит витаминов группы В, интоксикации мышьяком, метиловым спиртом, фосфорорганическими соединениями, угарным газом и т. д.), а также при наличии наследственного дефекта (болезнь Шарко–Мари типа 2).
Развитие аксонопатии характеризуется следующей клинической картиной:
- постепенное развитие;
- первоначальное вовлечение дистальных отделов конечностей, прежде всего ног, с развитием слабости иннервируемых мышц и угасанием дистальных рефлексов при длительной сохранности проксимальных рефлексов. Первыми поражаются наиболее длинные аксоны, иннервирующие мышцы стопы, в первую очередь короткий разгибатель пальцев стопы. Такие изменения возникают в результате нарушения аксоплазматического тока и доставки трофических факторов к наиболее удаленным участкам нерва;
- быстрое появление амиотрофий;
- расстройство болевой и температурной чувствительности по типу “носков” и “перчаток”;
- вегетативные нарушения [12].
Миелинопатии развиваются вследствие аутоиммунных процессов (синдром Гийена–Барре, хроническая воспалительная демиелинизирующая полиневропатия), токсических факторов (дифтерия), наследственных заболеваний (болезнь Шарко–Мари типа 1).
Для развития миелинопатии характерно:
- чаще острое или подострое развитие;
- вовлечение как дистальных, так и проксимальных отделов;
- раннее снижение или выпадение сухожильных рефлексов;
- выраженные нарушения глубокой чувствительности при сохранности болевой и температурной;
- более выраженные и распространенные парезы конечностей, но менее грубая атрофия мышц, развивающаяся в более отдаленные сроки (т. к. доставка трофических факторов нарушается лишь на поздних стадиях) [12].
Восстановление функции периферического нерва или корешка может продолжаться в течение нескольких месяцев или даже лет.
Длительность восстановительного периода во многом определяется адекватностью проводимых лечебных мероприятий, которые должны включать проведение этиопатогенетической терапии, начинаться как можно в более ранние сроки вне зависимости от причины заболевания и решать следующие основные задачи:
- стимулирование процессов ремиелинизации и регенерации;
- купирование болевого синдрома;
- предотвращение отека нерва и периневральных тканей;
- улучшение кровообращения;
- предупреждение трофических расстройств, контрактур [8].
Одним из важнейших направлений лечения является активация процессов регенерации и реиннервации, особенно в случае внешнего травматического повреждения нерва или при компрессионно-ишемических процессах. Даже при реконструкции анатомической непрерывности или декомпрессии нервного ствола регенераторный спрутинг протекает очень медленно и требует длительной консервативной терапии. Традиционно для активации процессов реиннервации используются антихолинэстеразные препараты. Кроме того, при поражении ПНС может нарушаться нервно-мышечная передача вследствие разрушения “старых” неэффективных синапсов, поэтому необходима ее стимуляция во вновь образующихся в результате спрутинга синапсах [15].
Механизм действия антихолиностеразных препаратов связан с блокадой ферментов, разрушающих ацетилхолин внутри синаптической щели и, таким образом, повышающих рабочую концентрацию медиатора вблизи постсинаптической мембраны. К числу указанных ферментов относятся ацетилхолинэстераза и бутирилхолинэстераза. Холинергические синапсы локализуются в головном мозге, ПНС, вегетативных ганглиях. Ингибирование распада ацетилхолина в головном мозге приводит к повышению уровня медиатора и улучшению мнестических процессов, что используется для лечения как альцгеймеровской деменции, так и сосудистых когнитивных нарушений [3–6]. Применение ингибиторов ацетилхолниэстеразы при заболеваниях ПНС приводит к стимуляции нервно-мышечной передачи, улучшению проведения импульса по периферическим нервам и вегетативным волокнам. В результате этого повышается сила сокращения скелетных мышц и сократимость гладкомышечной мускулатуры.
В настоящее время существует довольно большой выбор препаратов с антихолинэстеразным действием. Они различаются активностью, способностью проникать через тканевые барьеры, длительностью действия, наличием раздражающих свойств, токсичностью. Так, галантамин, ривастигмин и донепезил хорошо проникают через ГЭБ и используются для лечения когнитивной дисфункции. Прозерин, оксазил и калимин действуют периферически. Среди препаратов этой группы только ипидакрин обладает как центральными, так и периферическими эффектами, что обусловлено оригинальным механизмом его действия.
Ипидакрин представляет собой совместную разработку ВНЦ БАВ (Всероссийский научный центр по безопасности биологически активных веществ) и АО ГИАП (Научно-исследовательский и проектный институт азотной промышленности и продуктов органического синтеза) конца 1980-гг. По химической структуре ипидакрин представляет собой 9-амино-2,3,5,6,7,8-гесагидро-1Н-циклопентанхолина гидрохлорид моногидрат [11]. В СССР ипидакрин выпускался под торговым названием Амиридин. В настоящее время выпуск ипидакрина в России восстановлен фармацевтической компанией ПИК-ФАРМА под торговой маркой “Аксамон” в виде таблеток по 20 мг.
Механизм действия ипидакрина связан с блокадой ацетилхолинэстеразы в головном мозге и нервно-мышечных синапсах, а также с избирательной блокадой калиевых каналов мембран, что опосредованно увеличивает скорость вхождения ионов кальция в окончание аксона [11]. Именно влияние ипидакрина на транспорт ионов калия, по-видимому, является основным механизмом действия препарата. Блокада калиевых каналов вызывает удлинение периода возбуждения в пресинаптическом волокне во время прохождения нервного импульса, обеспечивает выход больших количеств ацетилхолина в синаптическую щель. Следует также отметить, что антихолинэстеразный эффект ипидакрина отличается кратковременностью (20–30 минут) и обратимостью, в то время как блокада калиевой проницаемости мембраны обнаруживается в течение 2 часов после введения препарата. В меньшей степени ипидакрин блокирует активность натриевых каналов. С действием ипидакрина на натриевую проницаемость мембраны можно частично связать его слабые седативные и анальгетические свойства.
В ряде исследований показано, что ипидакрин обладает свойствами частичного агониста М2-холинергических рецепторов, располагающихся в нервной и кардиальной тканях [6]. Этот эффект носит дозозависимый характер, и именно с ним связано влияние ипидакрина на механизмы нейропластичности. В настоящее время имеется опыт применения ипидакрина в восстановительном периоде инсульта, травматической болезни головного мозга, при нейродегенеративных процессах [9, 10]. Предполагается влияние ипидакрина не только на ацетилхолинергическую, но и ГАМКергическую системы, а также обмен катехоламинов.
Максимальная концентрация препарата в крови достигается через час после перорального приема, период полувыведения составляет 0,7 часа. Ипидакрин на 40–55 % связывается с белками крови, адсорбируется преимущественно из 12-перстной кишки, в меньшей степени – из желудка и кишечника. Элиминируется через почки и внепочечные механизмы (биотрансформация, секреция с желчью).
Результаты многочисленных исследований показали эффективность включения ипидакрина в комплекс лечения различных заболеваний ПНС [1, 2, 5, 7, 13, 14]. Прежде всего ипидакрин эффективен при компрессионно-ишемических и травматических поражениях периферических нервов и невропатии лицевого нерва. Назначение ипидакрина больным с нейропатиями конечностей в дополнение к сосудистой терапии и назначению витаминов группы В в дозе 40–80 мг/сут позволило сократить длительность восстановительного периода в среднем на 6,7 ± 2,1 дня [13]. Увеличивалась доля пациентов с наиболее полным восстановлением нарушенных функции. При своевременно начатом лечении эффект отмечен к 14–19-му дню [13, 14]. Положительная клиническая динамика подтверждалась результатами электрофизиологических исследований – электронейро- и электромиографии. Большинство авторов отмечают, что на фоне лечения ипидакрином увеличивались амплитуда М-ответа в мышцах кистей и стоп, амплитуда и длительность потенциалов двигательных единиц, уменьшалась резидуальная латентность, что указывает на активизацию процессов реиннервации [5, 13, 14]. Показатель резидуальной латентности отражает состояние окончаний двигательных аксонов. Снижение этого показателя демонстрирует улучшение аксональной трофики и рассматривается как хороший прогностический признак. Рядом авторов при длительном применении ипидакрина отмечено повышение скорости распространения возбуждения по периферическим нервам. Скорость распространения отражает активность ремиелинизирующих процессов и является более инертным показателем. В исследовании, проведенном на кафедре неврологии ММА им. И.М. Сеченова, отмечена эффективность назначения ипидакрина в дозе 60 мг/сут в течение 6 недель больным с диабетической полиневропатией [15].
Отдельно следует остановиться на возможностях применения ипидакрина у больных с невропатией лицевого нерва, обусловленной компрессионно-ишемическим процессом в области фаллопиева канала. Назначение антихолинэстеразных препаратов, в частности прозерина, этой категории больных часто сопряжено с опасностью развития вторичных контрактур. В опубликованных исследованиях, посвященных этому вопросу, ни у одного больного, получавшего ипидакрин в комплексной терапии в дозе 40–60 мг/сут, развитие мышечных контрактур не отмечено [1, 5, 13, 14]. В связи с этим ипидакрин можно назначать начиная с первых дней заболевания. На фоне приема ипидакрина увеличивался процент больных с полным восстановлением функций лицевого нерва, уменьшались сроки регресса пареза мимических мышц.
Накоплен большой опыт применения ипидакрина у пациентов с дорсопатиями поясничного отдела позвоночника. На фоне назначения ипидакрина отмечено достоверное снижение степени выраженности болевого синдрома, нарушений поверхностной чувствительности [2, 7]. Регресс болевого и других сенсорных симптомов, по-видимому, связан с блокадой К+/Na+-каналов. Именно с блокадой натриевых каналов связывают один из механизмов противоболевого эффекта габапентина. Вероятно, ипидакрин за счет удлинения периода реполяризации пресинаптической мембраны способен блокировать эктопические очаги и эфаптическую передачу возбуждения, которые являются причиной формирования боли, парестезий, крампи. Уменьшение крампи – это особенность действия ипидакрина, которая была отмечена в нескольких исследованиях: при диабетической полиневропатии, у больных с миастенией [5, 15].
Изучалась эффективность ипидакрина у больных миастенией и синдромом Ламберта–Итона. Курсовое назначение препарата в ряде случаев сопровождалось улучшением состояния, длительной ремиссией заболевания. Сравнение эффекта от однократного введения ипидакрина и прозерина показало, что ипидакрин начинал действовать в среднем на 5–10 минут позже, его действие было слабее, чем у прозерина, но продолжалось дольше – в среднем 3–5 часов. Прозерин заканчивал свое действие через 2,0–2,5 часа после введения. В целом эффективность ипидакрина при лечении миастении в монотерапии уступает таковой классических антихолинэстеразных препаратов, что отражает вторичность ингибирования ацетилхолинэстеразы в механизмах действия ипидакрина [5, 14].
Ипидакрин отличается хорошей переносимостью. Побочные эффекты сходны с таковыми группы ингибиторов ацетилхолинэстеразы и связаны с активацией М-холинорецепторов, но проявляются реже. Чаще всего встречаются тошнота, головокружение, увеличение частоты стула, усиление перистальтики. Побочные эффекты чаще всего возникают в начале терапии и проходят самостоятельно, либо при снижении дозы.
По данным клинических исследований, терапия ипидакрином не сопровождается отрицательной динамикой лабораторных показателей, изменениями артериального давления, частоты сердечных сокращений, ЭКГ, развитием гепатотоксичности [1, 2, 5–7, 9, 13–15]. Вместе с тем следует с осторожностью назначать ипидакрин больным со склонностью к брадикардии, при стенокардии. Ипидакрин противопоказан при эпилепсии, различных видах экстрапирамидных гиперкинезов, бронхиальной астме, в период беременности и лактации.
Таким образом, ипидакрин (Аксамон) представляется весьма эффективным препаратом для лечения моно- и полиневропатий различного генеза, невропатии лицевого нерва, дорсопатий. Включение ипидакрина в комплекс лечебных мероприятий позволяет повысить результативность лечения, сократить сроки восстановительного периода и не сопровождается риском развития мышечных контрактур. Помимо положительного влияния на восстановление проведения импульса по периферическим нервам и процесс реиннервации ипидакрин обладает противоболевым эффектом. Хорошая переносимость препарата позволяет рекомендовать его широкому кругу пациентов, в т. ч. и пожилого возраста с сопутствующей патологией.
ЛИТЕРАТУРА
1. Батышева Т.Т., Костенко Е.В., Бойко А.Н. Комплексное лечение невропатии лицевого нерва с применением нейромидина и антиоксидантой терапии // Психиатрия и психофармакотерапия. 2004. Т. 6. № 4. С. 199-202.
2. Бойко А.Н., БатышеваТ.Т. и др. Применение препарата аксамон в комплексной реабилитации больных с двигательными нарушениями при патологии поясничного отдела позвоночника // Журнал неврологии и психиатрии им. С.С. Корсакова. 2008. Т. 108. № 9. С. 45-47.
3. Букатина Е.Е., Смирнов О.Р., Григорьева И.В. Эффективность нейромидина при мультиинфарктной деменции // Социальная и клиническая психиатрия. 1992. Т. 2. С. 126-133.
4. Букатина Е.Е., Григорьева И.В., Сокольчик Е.И. Эффективность амиридина при сенильной деменции альцгеймеровского типа // Журнал неврологии и психиатрии им. С.С. Корсакова. 1991. № 9. С. 53-58.
5. Гехт Б.М. Нейромидин в лечении заболеваний периферического нейромоторного аппарата // Доктор Ру. 2003. С. 3-5.
6. Дамулин И.В. Использование ипидакрина (аксамона) в неврологической практике // Трудный пациент. 2007. Т. 5. № 11. С. 15-20.
7. Дзяк Л.А., Зорин Н.А. и др. Результаты комплексного лечения больных с радикулопатией и радикулоишемией, обусловленными патологией межпозвоночных дисков поясничного отдела позвоночника, с включением препарата нейромидин // Украинский нейрохирургический журнал. 2004. № 4. С. 98-101.
8. Жулев Н.М. Невропатии. Руководство для врачей. СПб., 2005.
9. Катунина Е.А. Холинергическая терапия в восстановительном периоде ишемического инсульта. Атмосфера // Нервные болезни. 2008. № 3. С. 2-8.
10. Козелкин А.А., Сикорская М.В., Козелкина С.А. Опыт применения препарата нейромидин у больных с ишемическими инсультами в остром и раннем восстановительном периоде // Украинский вестник психоневрологии. 2004. Т. 12. № 2. С. 12-14.
11. Лаврецкая Э.Ф. Амиридин. М., 1995. 22 с.
12. Левин О.С. Полиневропатии. Клиническое руководство. М., 2006. 496 с.
13. Парпалей И.А. и др. Применение нейромидина в комплексной терапии заболеваний периферической нервной системы // Украинский вестник психоневрологии. 2003. Т. 11. № 1(34).
14. Санадзе А.Г., Касаткина Л.Ф., Самойлов М.И. Применение нейромидина в лечении заболеваний периферической нервной системы // Атмосфера. Нервные болезни. 2003. № 3. С. 17-18.
15. Строков И.А., Зиновьева О.Е., Баринов А.Н. и др. Нейромидин в лечении диабетической невропатии // Неврологический журнал. 2007. Т. 12. № 6. С. 52-55.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
