Показания и противопоказания к лучевой терапии у детей
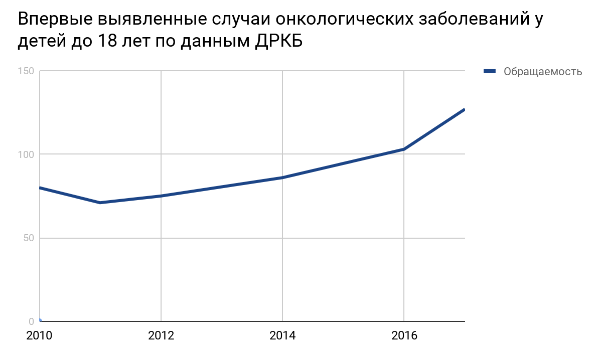

Онкологические заболевания являются серьезной проблемой, с которой можно повстречаться в любом возрасте, в том числе и в детском. Только в республике Татарстан на учете состоит свыше 800 ребятишек со злокачественными онкозаболеваниями. При этом отмечается неуклонный рост свежедиагносцированных случаев детской онкопатологии на протяжение всех последних лет.
По словам заведующей отделением онкогематологии ГАУЗ «Детская республиканская клиническая больница МЗ РТ» Ильсии Вагизовны Осиповой в отделении ежегодно медицинскую помощь получают до 1200 детей. Это ребятишки из Татарстана и других регионов РФ как с впервые выявленной патологией, так и поступающие на плановые курсы химиотерапии или плановые этапные обследования.
Что же касается структуры этих заболеваний, то первое место занимают гемобластозы, в том числе лейкозы и лимфомы. На эту патологию приходится свыше половины всех детских обращений. Следом располагаются новообразования центральной нервной системы, эмбриональные опухоли и саркомы. Некоторые злокачественные опухоли чаще встречаются в определенном возрасте. Так, например, нейробластомы, гепатобластомы и некоторые другие эмбриональные новообразования регистрируются чаще у младших детей, тогда как опухоли костей в большей мере выявляются у подростков. Злокачественные же заболевания крови (лейкозы) встречаются повсеместно без четкой связи с возрастом.
Принципы лечения
Существует три основных направления лечения онкологических больных: хирургическое, радиологическое и химиотерапевтическое. Выбор того или иного метода осуществляется на основании определенных критериев, которые представлены в клинических рекомендациях и протоколах. Часто используются комбинации методов, например, химиолучевая терапия после или перед операцией, и так далее. Сегодня постепенно начинают внедряться принципиально новые методы консервативного лечения, которые позволяют влиять на опухоль, минимально затрагивая здоровые ткани, однако, повсеместно они пока не применяются.
В детской практике особое значение имеет лучевая терапия, которая является зачастую единственно возможным методом лечения, как, например, при некоторых новообразованиях ЦНС. Лучевая терапия, кроме того, входит в стандарты лечения лимфомы Ходжкина, сарком мягких тканей, нейробластом и многих других онкологических заболеваний, а также является средством “сдерживающей терапии” при агрессивно протекающих доброкачественных новообразованиях, когда по каким-либо причинам невозможно их радикальное лечение.
Фактором, который ограничивает применение лучевого лечения, остается негативное влияние ионизирующего излучения на здоровые ткани, вследствие чего объемов и доз облучения не всегда достаточно для решения поставленных задач без угрозы для здоровья пациента. Выходом из этой ситуации может стать применение современных радиологических методов лечения, и в частности лучевая терапия с модулированной интенсивностью (IMRT), которая позволяет точно подвести дозу радиации к опухоли, максимально оберегая здоровые ткани.
Статистика лечения детей с онкологическими заболеваниями в республике Татарстан сопоставимы с мировыми статистическими данными. Сегодня можно достаточно оптимистично оценивать прогноз пациента при таких новообразованиях как острые лимфобластные лейкозы и неходжкинские лимфомы, 5-летняя выживаемость при которых достигает до 86-88%, а выход в ремиссию составляет до 95-100% случаев. Более того, при некоторой онкопатологии (ретинобластома и нефробластома), можно уверенно говорить практически о 100% 5-летней выживаемости. Самое приятное, что когда мы говорим о 5-летней бессобытийной выживаемости при перечисленных опухолях, мы практически говорим об излечении пациента. К сожалению, существуют и новообразования, с которыми медицине пока не удается справиться так эффективно. Так, например при острых миелобластных лейкозах 5-летняя выживаемость не превышает 50%.
Стоимость лечения рака у детей
| Наименование услуги | Цена, руб. | Ед. измерения |
|---|---|---|
| Консультация врача онколога радиотерапевта | шт. | |
| Консультация врача детского онколога | шт. | |
| Повторная консультация специалистов | 500 | шт. |
| Топометрия на специализированном компьютерном томографе первичная | 15 000 | процедура |
| Топометрия на специализированном компьютерном томографе повторная | 7 000 | процедура |
| Дозиметрическое планирование лучевой терапии (томотерапии) первичное | 20 000 | шт. |
| Дозиметрическое планирование лучевой терапии (томотерапии) повторное | 7 000 | шт. |
| Лучевая терапия (томотерапия), включая IMGRT (*) | 223 000 | курс |
| Лучевая терапия (томотерапия) стереотаксическая радиохирургия(*) | 250 000 | курс |
| Лекарственная сопроводительная терапия: внутривенные введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 1 000 | процедура |
| Лекарственная сопроводительная терапия: внутримышечное введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 200 | процедура |
| Топометрическая разметка | 750 | процедура |
Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
Меры профилактики
В настоящее время медицина пока не может предложить надежного способа предотвратить онкологическое заболевание у ребенка или спрогнозировать его. Все что нам остается, это следить за общим состоянием своих детей, чтобы своевременно принять меры. Существует две группы проявлений, характерных для патологии онкологического профиля:
- Общие симптомы, такие как потеря веса, слабость, нарушение аппетита, бледность кожных покровов.
- Специфические симптомы, отмечающиеся при опухолях определенных локализаций, например, кровь в моче при новообразованиях мочевого пузыря или нарушения стула при опухолях кишечника.
Очень часто онкологические заболевания подолгу протекают бессимптомно, что еще более выражено у детей за счет их в целом хороших адаптационных качеств.
Конечно, не нужно впадать в панику и ежемесячно сдавать тонны анализов, опасаясь развития онкопатологии у ребенка. Достаточно просто быть с ним рядом, присматривать за ним, а при изменениях в его самочувствии показать врачу. Скорее всего ничего страшного не случилось, но определенную настороженность необходимо сохранять всегда.
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн — консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
Дата написания: 07.09.18
Дата обновления: 22.10.19
Проверил: Моров Олег Витальевич
Показания к лучевой терапии злокачественных опухолей. В настоящее время показания к лучевому лечению злокачественных опухолей достаточно широки – 65-70% онкологических больных как в неоперабельной, так и в операбельной стадиях заболевания подлежат такому лечению.
Показания к лучевой терапии определяются на основании всесторонней оценки состояния органов и систем больного и характеристики выявленного опухолевого поражения. Поэтому с помощью клинических, лучевых, инструментальных и лабораторных методов определяют состояние органов и систем больного, локализацию и характер роста опухолей, стадию ее развития. Там, где это возможно, стадию устанавливают по системе TNM, где Т – параметры опухоли, N – наличие или отсутствие вовлечения лимфоузлов, а М – наличие или отсутствие отдаленных метастазов. Требуется морфологическое подтверждение клинического диагноза посредством биопсии, цитологического изучения пунктатов или смывов. Главной стратегической основой успешности хирургического, лучевого и медикаментозного лечения является ранняя диагностика опухолевого процесса. В онкологической клинике применяют три основных (специальных) варианта лечения больного: хирургический, лучевой и химиотерапевтический. План лечения определяется консилиумом в составе: хирурга (онколога), лучевого терапевта и химиотерапевта, а также других специалистов в зависимости от клинической ситуации.
Противопоказания к лучевой терапии:
1. Распад опухоли с нагноением и/или кровотечением.
2. Прорастание в полые органы.
3. Наличие отдаленных (особенно множественных) метастазов.
4. Общее тяжелое состояние больного за счет интоксикации.
5. Кахексия.
6. Выраженная анемия, лейкопения, тромбоцитопения.
7. Септические заболевания, активный туберкулез легких.
8. Недавно перенесенный инфаркт миокарда (менее года назад).
9. Декомпенсация кровообращения, функции печени и почек.
Варианты лучевой терапии
Лучевая терапия как самостоятельный метод лечения может быть проведена по радикальной программе, использована как паллиативное и симптоматическое средство помощи больным.
Радикальная лучевая терапия направлена на полное излечение больного от опухоли и регионарных метастазов путем подведения канцерицидной дозы радиации. Уровни канцерицидных доз для различных опухолей неодинаковы и устанавливаются в зависимости от гистологического ее строения, митотической активности и степени дифференцировки клеточных элементов. К числу опухолей, поддающихся радикальному лечению (радиокурабельные опухоли), относят рак кожи, губы, носоглотки, гортани, молочной железы, шейки матки и эндометрия, предстательной железы, а также семиномы, локализованные лимфомы, лимфогранулематоз, аденомы гипофиза. Понятно, успех может быть достигнут на относительно ранних стадиях.
Паллиативная лучевая терапия предпринимается для уменьшения размеров опухоли и ее метастазов, стабилизации опухолевого роста и используется в тех случаях, когда невозможна лучевая терапия по радикальной программе, при этом суммарная очаговая доза (СОД), как правило, составляет 2/3 канцерицидной.
Симптоматическая лучевая терапия применяется для снятия или уменьшения клинических симптомов злокачественного поражения, могущих привести к быстрой гибели больного или существенно ухудшающих качество его жизни. Облучение с симптоматической целью проводится по жизненным показаниям при опухолях таких локализаций, при которых лучевая терапия – единственный метод лечения (синдром сдавления верхней полой вены, компрессионный синдром, обусловленный быстрорастущей опухолью мозга, острая асфиксия при быстрорастущей опухоли трахеи, первичные и метастатические опухоли, вызывающие сдавление спинного мозга). Суммарная поглощенная доза излучения устанавливается индивидуально, в зависимости от достигнутого эффекта.
Комбинированное лечение. Этот термин используется, когда в той или иной последовательности для специального лечения злокачественных опухолей применяется оперативное лечение и лучевая терапия. Лучевая терапия в комбинации с хирургическим вмешательством может быть использована в предоперационном периоде, после операции и интраоперационно.
Предоперационное облучение проводится с целью улучшения условий выполнения радикальной операции и снижения частоты развития местных рецидивов и отдаленных метастазов. Задачи предоперационной лучевой терапии:
Разрушение наиболее радиочувствительных клеток и понижение жизнеспособности оставшихся опухолевых элементов;
Устранение воспалительных явлений в опухоли и вокруг нее;
Стимуляция и развитие соединительной ткани и инкапсуляция отдельных комплексов раковых клеток;
Облитерация мелких сосудов, ведущая к понижению васкуляризации стромы опухоли и тем самым к уменьшению опасности метастазирования;
Перевод опухолей в операбельное состояние.
Многолетний опыт проведения комбинированного лечения показывает, что очаговая доза не более 40 Гр, подводимая по 2 Гр ежедневно в течение 4 недель, не вызывает затруднений при выполнении последующей операции и не оказывает заметного влияния на заживление послеоперационной раны. То же можно сказать и о других режимах фракционирования по биологическому эффекту эквивалентных 40 Гр обычным фракционированием (25 Гр за 5 фракций). Доза 40-45 Гр приводит к гибели 90-95% субклинических очагов опухолевого роста. Превышение дозы 40-45 Гр, хотя и желательно для усиления повреждающего эффекта на опухолевые клетки, но может увеличить частоту послеоперационных осложнений. В настоящее время наиболее часто используют две методики предоперационного дистанционного облучения:
1. ежедневное облучение первичной опухоли и регионарных зон в дозе 2 Гр до СОД 40-45 Гр за 4-4,5 недели лечения;
2. облучение аналогичных объемов в дозе 5 Гр в течение 5 дней до СОД 25 Гр.
В первом варианте операцию выполняют через 2-3 недели, а во втором – не позднее 1-3 дней; она рекомендуется только для лечения больных с операбельными злокачественными опухолями.
Послеоперационная лучевая терапия имеет цель: увеличить эффективность операции с помощью лучевого воздействия на оставленные или имплантированные во время хирургического лечения (вмешательства) опухолевые элементы. Послеоперационное облучение, как и предоперационное, в конечном итоге, направлено на предупреждение рецидивов и уменьшение метастазирования злокачественной опухоли. Ее задачи:
1. “стерилизация” операционного поля от рассеянных в процессе оперативного вмешательства злокачественных клеток и их комплексов;
2. эрадикация оставшихся злокачественных тканей после неполного удаления опухоли и метастазов.
Показания к проведению послеоперационного облучения: в случаях, когда оперативное вмешательство радикально выполнить невозможно (опухоли ЦНС, ротоглотки, забрюшинного пространства), выход опухоли за пределы того слоя, в котором она возникла, распространение по лимфатической системе, органосохраняющие операции.
Следует заметить, что послеоперационное облучение проводится в условиях, способствующих повышению радиорезистентности опухолевых клеток (из-за нарушения крово- и лимфообращения). Одновременно радиочувствительность нормальных тканей в состоянии регенерации повышается. Все это приводит к уменьшению радиотерапевтического интервала. Однако можно отметить определенные достоинства послеоперационной лучевой терапии:
1. выбор объема и методики облучения проводят на основании данных, полученных во время операции и после тщательного морфологического изучения удаленных тканей;
2. оперативное лечение выполняют максимально быстро, после уточняющей диагностики.
Послеоперационное облучение проводят при условии полного заживления послеоперационной раны, через 2-3 недели после операции. Облучают обычными фракциями в СОД 50 Гр при отсутствии злокачественных клеток в операционных разрезах, при их наличии – 60 Гр.
Интраоперационная лучевая терапия предусматривает однократное облучение операционного поля или неоперабельных опухолей во время лапаротомии электронным пучком с энергией 10-15 МэВ в дозе 14-20 Гр.
Комплексная лучевая терапия предусматривает сочетанное использование лучевой и химиотерапии и преследует двоякую цель: взаимное усиление воздействия ионизирующей радиации и химиотерапии на первичную опухоль (достижение аддитивного, потенцирующего и синхронизирующего эффектов), а также создание условий для профилактики метастазов и лечения субклинических или же выявленных метастазов. Различают два основных варианта комплексного лечения:
1. когда лучевая терапия – основной, или базовый, метод, а химио-гормональное лечение – дополнительный, направленный на излечение отдаленных метастазов, при этом подводится СОД не ниже 60 Гр.
Так, при комплексном лечении больных инфильтративно-отечными формами рака молочной железы облучение проводят в дозах не менее 60 Гр на молочную железу, 55-60 Гр на зоны регионарного метастазирования. Адъювантная химиогормонотерапия направлена на эрадикацию возможных субклинических отдаленных метастазов и в меньшей степени на повреждение первичного очага в молочной железе (это относится и к немелкоклеточному раку легкого, головы, шеи, пищевода, эндометрия и т.д.).
2. когда ионизирующее излучение используется как адъювантное средство химиолучевого лечения. В этих случаях дозы облучения могут быть уменьшены на 1/3 от “канцерицидной” и составляют 30-36 Гр. Применяется при лечении опухолей яичка, нефробластомах, лимфогранулематозе, злокачественных неходжкинских лимфомах.
Используется, как правило, вариант обычного фракционирования дозы, т.к. возможен синергизм и в отношении поражения здоровых тканей. Последовательность может варьировать в зависимости от конкретной локализации.
Мультимодальная терапия онкологических больных предусматривает оптимальное использование современных методов хирургического, лучевого и лекарственного лечения, а также сочетание их с радиомодифицирующими воздействиями.
Принципы лучевой терапии злокачественных опухолей:
1. Максимальное лучевое воздействие на опухолевую ткань, минимальное – на здоровую ткань.
2. Эффективность лучевого лечения в решающей степени зависит от стадии заболевания, поэтому облучение следует начинать как можно раньше.
3. Для достижения благоприятного конечного результата важно добиваться максимальной радикальности первого курса лучевого лечения, что достигается обязательным облучением всей опухоли в необходимой дозе и в оптимальные сроки.
4. Под необходимой дозой понимают такую, которая достаточна для получения запланированного эффекта при учете величины опухоли, характера ее роста (преобладание экспансивного или инфильтративного роста), радиочувствительности опухолевой ткани и некоторых других факторов. Необходимая суммарная очаговая доза при лечении по радикальной программе 60-80 Гр должна быть получена всем опухолевым узлом, тогда как на пути лимфооттока и на зоны регионарного метастазирования достаточной является доза, составляющая около 80% очаговой (при отсутствии в них метастазов).
5. Под оптимальными сроками облучения понимают такую общую продолжительность лечения и распределения дозы во времени (т.е. способы фракционирования), при которых достигается существенное подавление опухолевого роста при сохранении достаточной степени регенераторных способностей окружающих опухоль здоровых тканей. Таким образом, облучение в оптимальные сроки является одним из важных условий поддержания максимальной величины радиотерапевтического интервала (различие в радиопоражаемости опухоли и окружающих здоровых тканей), что, в свою очередь, в значительной степени определяет результаты лечения.
6. Сохранению и увеличению радиотерапевтического интервала способствуют, помимо распределения дозы во времени, воздействие на радиочувствительность опухолевой ткани путем применения радиопротекторов и радиосенсибилизаторов, а также использование таких видов излучений и таких методик облучения, которые обеспечивают наилучшее распределение дозы.
7. Эффективность лучевого лечения в значительной степени зависит от своевременности применения патогенетически обоснованного сопутствующего лечения, направленного на дезинтоксикацию и нормализацию функций организма облученного пациента, снятие воспалительного процесса в зоне облучения и предупреждение возникновения лучевых реакций и повреждений. Сопутствующее лечение включает психологическую подготовку, режим питания с использованием радиопротекторных свойств пищи, витаминотерапию, гемотрансфузию, лекарственное лечение, лечебную физкультуру, уход за кожей.
Клинико-дозиметрическое планирование лучевой терапии
Основной принцип лучевой терапии – излечение опухоли при максимальном щажении нормальных органов и тканей. Для реализации его в клинике большое внимание уделяется разработке способов повышения эффективности лучевого воздействия на основе пространственного и временного распределения дозы ионизирующего излучения и применения средств, изменяющих (модифицирующих) лучевые реакции опухоли и организма.
Цель планирования лучевой терапии — включение в зону облучения минимально возможного объема тканей, но в то же время достаточного для воздействия на все опухолевые элементы. Исходя из этого, различают 5 типов объемов облучения. Большой (макроскопический) объем опухоли (БОО) включает видимую опухоль. Клинический объем мишени (КОМ) включает видимую опухоль и объемы предполагаемого субклинического распространения. Концепция КОМ является клинико-анатомической. Планируемый объем мишени (ПОМ) включает КОМ и окружающие ткани с поправкой на вариации в размере, форме и положении относительно лечебных пучков, поэтому ПОМ является геометрической концепцией. Объем, который получает дозу, достаточную для радикального или паллиативного лечения с учетом толерантности нормальных тканей, обозначается как объем лечения. Наиболее оптимальное распределение дозы излучения достигается при объемном (трехмерном) планировании. Объемное планирование лежит в основе конформного облучения, при котором во время перемещения пучка излучения поле облучения регулируется по форме и размерам в соответствии с изменением поперечного сечения мишени, перпендикулярного направлению пучка в пространстве.
Служба предлучевой подготовки предназначена для проведения комплексной топометрии больных, подлежащих различным видам лучевой терапии с использованием биометрических, рентгенологических, изотопных, УЗ и МРТ методов исследования, для клинико-дозиметрического обеспечения курса лучевой терапии.
Предлучевая подготовка и клиническая топометрия. Основой лучевого лечения онкологических больных является правильное подведение заданной дозы к злокачественному очагу при минимальном облучении окружающих его здоровых органов и тканей. Определение размеров, площади, объема патологических образований, органов и анатомических структур, описание в количественных терминах их взаимного расположения (синтопии) у конкретного больного называется клинической топометрией. Для того, чтобы выбрать варианты и параметры программы облучения, нужно знать форму и размеры очага-мишени, ее ориентацию в теле пациента, а также синтопию окружающих органов и тканей, расстояние между мишенью и наиболее важными, с точки зрения распределения лучевой нагрузки, анатомическими структурами и «критическими органами». Эти сведения позволяют получить различные методы лучевой диагностики, но наиболее часто применяется для этих целей рентгеновская компьютерная томография. Данные, полученные при выполнении оперативных вмешательств, также позволяют определить размеры опухоли. Затем изготавливают схемы сечения тела на уровне “мишени”– так называемые топометрические схемы (т.е. производят клиническую топометрию). Современные системы дозиметрического планирования воспринимают топометрическую информацию непосредственно с магнитного носителя КТ и печатают топометрическую карту с нанесенным на ней выбранным распределением изодоз. Изодозные линии соединяют точки с одинаковым значением поглощенной дозы. Отмечают относительные значения – в процентах от максимальной поглощенной дозы, принимаемой за 100%. Для расчета изодозных кривых используются специальные компьютерные программы, которые учитывают пространственные параметры облучаемого объекта и дозиметрическую характеристику применяемого пучка излучения. Для того, чтобы составить представление о распределении поглощенных доз в облучаемом объеме, на топометрические схемы наносят изодозные кривые и получают, таким образом, карту изодоз. В практике лучевой терапии дозное распределение считают приемлемым, если вся опухоль заключается в дозе 100-90%, зона субклинического распространения опухоли и регионарного метастазирования находится в пределах 80% изодозы, а здоровые ткани – не более 50-30% изодозы.
