Антибиотики классификация механизм действия побочные эффекты
Антибиотики (от греч. anti—против, bios—жизнь) —это химические соединения биологического происхождения, оказывающие избирательное повреждающее или губительное действие на микроорганизмы. Антибиотики, применяемые в медицинской практике, продуцируются актиномицетами (лучистыми грибами), плесневыми грибами, а также некоторыми бактериями. К этой группе препаратов относят также синтетические аналоги и производные природных антибиотиков.
Классификация Существуют антибиотики с антибактериальным, противогрибковым и противоопухолевым действием.
В настоящем разделе будут рассмотрены антибиотики, влияющие преимущественно на бактерии. Они представлены следующими группами:

По спектру антимикробного действия антибиотики отличаются довольно существенно. Одни влияют преимущественно на грамположительные бактерии (биосинтетические пенициллины, макролиды), другие — в основном на грамотрицательные бактерии (например, полимиксины). Ряд антибиотиков обладает широким спектром действия (тетрациклины, левомицетин и др.), включающим грамположительные и грамотрицательные бактерии, риккетсии, хламидии (так называемые крупные вирусы) и ряд других возбудителей инфекций (табл. 27.1; рис. 27.1).
Механизм действия
Таблица 27.1. Основной механнзм н характер антнмнкробного действия антнбиотиков
Спектр действия | Антибиотики | Основной механизм антимикробного действия | Преимущественный характер антимикробного действия |
Антибиотики, влияющие преимущественно на грамположи-тельные бактерии | Препараты бензилпеницил-лина Полусинтетические пеницил-лины Эритромицин Олеандомицин | Угнетение синтеза клеточной стенки То же Угнетение синтеза белка То же | Бактерицидный Бактериостатичес-кий |
Антибиотики, влияющие на грамотрица-тельные бактерии | Полимиксины | Нарушение проницаемости цитоплазматической мембраны | Бактерицидный |
Антибиотики широкого спектра действия | Тетрациклины Левомицетин Стрептомицин Неомицин Мономицин Канамицин Ампициллин Имипенем Цефалоспорины Рифампицин | Угнетение синтеза белка То же Угнетение синтеза клеточной стенки То же Угнетение синтеза РНК | Бактериостатический Бактерицидный |

Рис. 27.1. Примеры антибиотиков с разными спектрами антибактериального действия.
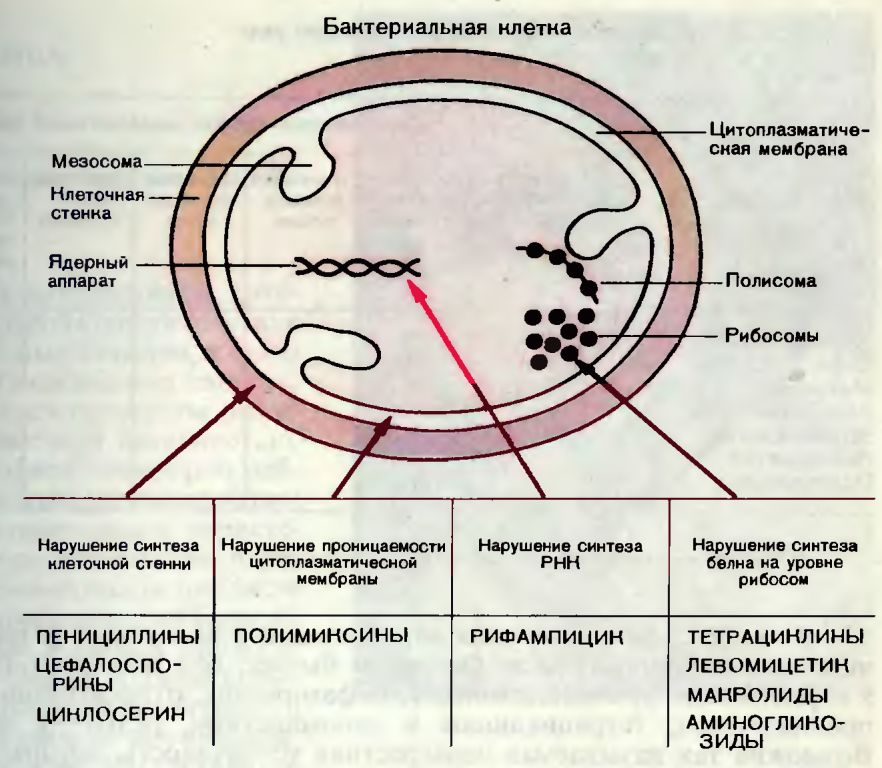
Рис. 27.2. Основные механизмы антимикробного действия антибиотиков.
Антибиотики воздействуют на микроорганизмы, либо подавляя их размножение (бактериостатический эффект), либо вызывая их гибель (бактерицидный эффект).
Известны следующие основные механизмы антимикробного действия антибиотиков (рис. 27.2):
1) нарушение синтеза клеточной стенки бактерий (по такому принципу действуют пенициллины, цефалоспорины);
2) нарушение проницаемости цитоплазматической мембраны (например, полимиксинами);
3) нарушение внутриклеточного синтеза белка (так действуют тетрациклины, левомицетин, стрептомицин и др.);
4) нарушение синтеза РНК (рифамницин).
Высокая избирательность действия антибиотиков на микроорганизмы при их малой токсичности в отношении макроорганизма, очевидно, объясняется особенностями структурной и функциональной организации микробных клеток. Действительно, клеточная стенка бактерий по химическому составу принципиально отличается от мембран клеток млекопитающих. Состоит клеточная стенка бактерий из мукопептида муреина (содержит N-ацетил-глюкозамин, N-ацетил-мурамовую кислоту и пептидные цепочки, включающие некоторые L- и D-аминокислоты). В связи с этим вещества, нарушающие ее синтез (например, пенициллины), обладают выраженным антимикробным действием и практически не влияют на клетки макроорганизма. Определенную роль, возможно, играет неодинаковое количество мембран, окружающих те 1 активные центры, с которыми могут взаимодействовать антибиотики. Так, в отличие от микроорганизмов у клеток млекопитающих, помимо общей плазматической мембраны, все внутриклеточные органеллы имеют свои, иногда двойные, мембраны. По-видимому, важное значение принадлежит отличиям в химическом составе отдельных клеточных компонентов. Следует учитывать также существенные различия в темпе роста и размножения клеток макро- и микроорганизмов, а следовательно, и скорости синтеза их структурных материалов. В целом проблема избирательности действия антибиотиков, как и других антимикробных средств, нуждается в дальнейших исследованиях.
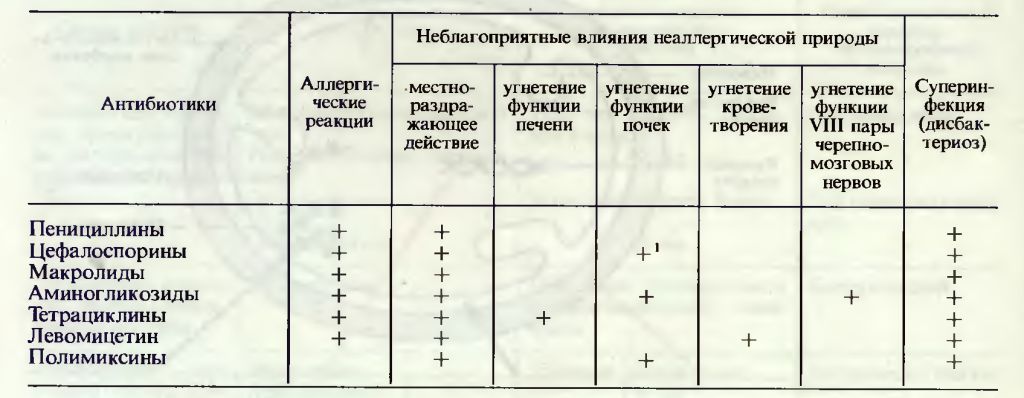
Таблица 27.2. Возможные неблагоприятные влияния ряда антибиотиков

1 Отмечается в основном при применении цефалоридина.
В процессе использования антибиотиков к ним может развиваться устойчивость микроорганизмов. Особенно быстро она возникает по отношению к стрептомицину, олеандомицину, рифампицину, относительно медленно — к пенициллинам, тетрациклинам и левомицетину, редко—к полимиксинам. Возможна так называемая перекрестная устойчивость, которая относится не только к применяемому препарату, но и к другим антибиотикам, сходным с ним по химическому строению (например, ко всем тетрациклинам). Вероятность развития устойчивости уменьшается, если дозы и длительность введения антибиотиков оптимальны, а также при рациональной комбинации антибиотиков. Если к основному антибиотику возникла устойчивость, его следует заменить другим, «резервным» (Резервные антибиотики по одному или по ряду свойств уступают основным антибиотикам (обладают меньшей активностью либо более выраженными побочными эффектами, большей токсичностью или быстрым развитием резистентности к ним микроорганизмов). Поэтому их назначают лишь при устойчивости микроорганизмов к основным антибиотикам.), антибиотиком.
Побочное действие Хотя антибиотики и характеризуются высокой избирательностью действия, тем не менее они оказывают и целый ряд неблагоприятных влияний на макроорганизм. Так, при использовании антибиотиков нередко возникают аллергические реакции немедленного и замедленного типов (сывороточная болезнь, крапивница, ангионевротический отек, анафилактический шок, контактные дерматиты и др.).
Кроме того, антибиотики могут обладать побочными свойствами неаллергической природы и токсическим действием. Результатом прямого раздражающего действия антибиотиков являются диспепсические явления (тошнота, рвота, понос), болезненность на месте внутримышечного введения препарата, развитие флебитов и тромбофлебитов при внутривенных инъекциях антибиотиков. Неблагоприятные эффекты возможны также со стороны печени, почек, кроветворения, слуха, вестибулярного аппарата и др. (примеры приведены в табл. 27.2).
Для многих антибиотиков типично развитие суперинфекции (дисбактериоз), которая связана с подавлением антибиотиками части сапрофитной флоры, например пищеварительного тракта. Последнее может благоприятствовать размножению других микроорганизмов, не чувствительных к данному антибиотику (дрожжеподобных грибов, протея, синегнойной палочки, стафилококков). Наиболее часто суперинфекция возникает на фоне действия антибиотиков широкого спектра действия.
Несмотря на большое распространение антибиотиков в медицинской практике, поиски новых, более совершенных препаратов этого типа ведутся в довольно значительных масштабах. Усилия исследователей направлены на создание таких антибиотиков, которые в максимальной степени сочетали положительные качества и были лишены отрицательных свойств. Такие «идеальные» препараты должны обладать высокой активностью, выраженной избирательностью действия , необходимым антимикробным спектром, бактерицидным характером дествия, проницаемостью через биологические мембраны (в том числе гематоэнцефалический барьер), эффективностью в разных биологических средах. Они не должны вызывать быстрого развития устойчивости микроорганизмов и сенсибилизации макроорганизма. Отсутствие попочных эффектов, минимальная токчность и большая широта терапевтического действия — все это также относится к числу основных требований, предъявляемых к новым антибиотикам. Кроме того, важно, чтобы препараты антибиотиков были технически доступны для приготовления на фармацевтических предприятиях и имели низкую стоимость.
Харкевич Д. А. Фармакология
Антибиотики – высокоактивные метаболические продукты микроорганизмов, избирательно подавляющие рост различных бактерий. По механизму антимикробного действия антибиотики в значительной мере отличаются друг от друга. «Мишенью» для их ингибирующего действия служит одна или несколько биохимических реакций, необходимых для синтеза и функционирования определённых морфологических компонентов или органоидов микробной клетки.
Классификация:
1. Антибиотики, подавляющие синтез бактериальной клеточной стенки.
Пенициллины – продуцируются грибами рода Penicillium, блокируют последнюю стадию синтеза муреина, антибактериальный спектр бензилпенициллина (фермент бактерий пенициллиназа, или β-лактамаза, гидролизует его β-лактамное кольцо и лишает активности) включает патогенные кокки, спирохеты и некоторые грамположительные бактерии (дифтерия, сибирская язва, анаэробной инфекции),полусинтетические пенициллины (ампициллин) эффективны также против ряда грамотрицательных бактерий (кишечная палочка, сальмонеллы, шигеллы, клебсиеллы).
Цефалоспорины – продуцируются грибами рода Cephalosporium, механизм действия тот же, полусинтетический аналог цефалоспорина – цефалоридин =ампициллин.
2. Антибиотики, нарушающие функции ЦПМ микроорганизмов.
Полиеновые антибиотики (нистатин, леворин) – продуцируются актиномицетами, к ним чувствительны патогенные грибы, в том числе рода Candida, микоплазмы и некоторые простейшие, механизм действия связан с их адсорбцией на ЦПМ и взаимодействием с её стерольным компонентом → потеря водорастворимых веществ и гибель клетки.
Грамицидин – продуцируется палочкой B. Brevis, угнетает энергетические реакцииклетки, наиболее чувствительны к нему стафилококки, стрептококки, клостридии, токсичен (применяется только местно).
Полимиксин – продуцируется Bacillus polymyxa, нарушает жизненно важные функции ЦПМ бактерий, эффективен против грамотрицательных бактерий (энтеробактерии, синегнойная палочка и др.).
3. Антибиотики, ингибирующие синтез белка на рибосомах бактериальных клеток. Продуцентами являются актиномицеты.
Аминогликозиды – блокируют синтезбелка путём воздействия на 30S субъединицу рибосомы, а также нарушаютсчитывание генетического кода, стрептомицин эффективен против микобактерий туберкулёза и многих грамотрицательных бактерий (энтеробактерии, бруцеллы, бактерии чумы, туляремии, холерный вибрион и др.), канамицин и неомицин эффективны против многих грамположительных бактерий, гентамицин более эффективен в отношении синегнойной и кишечной палочек, протеев и стафилококков.
Тетрациклины – нарушают связывание аминоацил-тРНК с рибосомально-матричным, а также подавление окисления глутаминовой кислоты у риккетсий Провацека, антибактериальный спектр включает многие грамположительные и грамотрицательные бактерии, спирохеты, риккетсии, хламидии, микоплазмы. Левомицетин – подавление пептидилтрансферазной реакции с 50S субъединицей рибосомы, то же + пневмококки, гонококки. Макролиды (эритромицин, олеандомицин) – блокируют синтез белка путём воздействия на 50S субъединицу рибосомы, активны в отношении патогенных кокков, некоторых грамположительных бактерий, риккетсий и хламидий; антибиотики«резерва».
4. Антибиотики, подавляющие синтез белка на уровне транскрипции.
Рифамицины – подавляют активность ДНК-зависимой РНК-полимеразы, эффективны в отношении грамположительных бактерий и микобактерий туберкулёза.
5. Антибиотики, подавляющие репликацию ДНК.
Новобиоцин – угнетает ДНК-полимеразу, а также блокирует синтез РНК и клеточной стенки бактерий, антибактериальный спектр включает стафилококки, стрептококки, менингококки, гонококки, палочки инфлюэнцы, дифтерийные бактерии и др.; антибиотик «резерва».
Механизм действия антибиотиков – это изменения в структуре и обмене веществ и энергии микроорганизмов, которые ведут к гибели микроорганизмов, приостановке его роста и размножения:
1. Нарушение синтеза клеточной стенки бактерий (пенициллин, цефалоспорины)
2. Тормозят синтез белка в клетке (стрептомицин, тетрациклин, левомицетин)
3. Угнетают синтез нуклеиновых кислот в микробной клетке (рифампицилин)
4. Угнетают ферментные системы (грамицидин)
Антибиотики
— химиотерапевтические вещества,
продуцируемые микроорганизмами,
животными клетками, растениями, а также
их производные и синтетические продукты,
которые обладают избирательной
способностью угнетать и задерживать
рост микроорганизмов, а также подавлять
развитие злокачественных новообразований.
За
тот период, который прошел со времени
открытия П.Эрлиха, было получено более
10 000 различных антибиотиков, поэтому
важной проблемой являлась систематизация
этих препаратов. В настоящее время
существуют различные классификации
антибиотиков, однако ни одна из них не
является общепринятой.
В
основу главной классификации
антибиотиков положено их химическое
строение.
Наиболее
важными классами синтетических
антибиотиков являются хинолоны и
фторхинолоны (например, ципрофлоксацин),
сульфаниламиды (сульфадиметоксин),
имидазолы (метронидазол), нитрофураны
(фурадонин, фурагин).
По
спектру действия
антибиотики делят на пять групп в
зависимости от того, на какие
микроорганизмы они оказывают воздействие.
Кроме того, существуют противоопухолевые
антибиотики, продуцентами которых
также являются актиномицеты. Каждая
из этих групп включает две подгруппы:
антибиотики широкого и узкого спектра
действия.
Антибактериальные
антибиотики
составляют самую многочисленную группу
препаратов. Преобладают в ней антибиотики
широкого спектра действия, оказывающие
влияние на представителей всех трех
отделов бактерий. К антибиотикам широкого
спектра действия относятся аминогликозиды,
тетрациклины и др. Антибиотики узкого
спектра действия эффективны в
отношении небольшого круга бактерий,
например полет-миксины действуют на
грациликутные, ванкомицин влияет на
грамположительные бактерии.
В
отдельные группы
выделяют противотуберкулезные,
противолепрозные, противосифилитические
препараты.
Противогрибковые
антибиотики
включают значительно меньшее число
препаратов. Широким спектром действия
обладает, например, амфотерицин В,
эффективный при кандидозах, бластомикозах,
аспергиллезах; в то же время нистатин,
действующий на грибы рода Candida,
является антибиотиком узкого спектра
действия.
Антипротозойные
и антивирусные антибиотики
насчитывают небольшое число препаратов.
Противоопухолевые
антибиотики
представлены препаратами, обладающими
цитотоксическим действием. Большинство
из них применяют при многих видах
опухолей, например митоми-цин С.
Действие
антибиотиков на микроорганизмы связано
с их способностью подавлять те или
иные биохимические реакции, происходящие
в микробной клетке.
В
зависимости от механизма действия
различают пять групп антибиотиков:
1.
антибиотики, нарушающие синтез клеточной
стенки. К этой группе относятся, например,
β-лактамы. Препараты этой группы
характеризуются самой высокой
избирательностью действия: они
убивают бактерии и не оказывают влияния
на клетки микроорганизма, так как
последние не имеют главного компонента
клеточной стенки бактерий — пептидогликана.
В связи с этим β -лактамные антибиотики
являются наименее токсичными для
макроорганизма;
2.
антибиотики, нарушающие молекулярную
организацию и синтез клеточных мембран.
Примерами подобных препаратов
являются полимиксины, полиены;
3.
антибиотики, нарушающие синтез белка;
это наиболее многочисленная группа
препаратов. Представителями этой группы
являются аминогликозиды, тетрациклины,
макроли-ды, левомицетин, вызывающие
нарушение синтеза белка на разных
уровнях;
4.
антибиотики — ингибиторы синтеза
нуклеиновых кислот. Например, хинолоны
нарушают синтез ДНК, рифампицин — синтез
РНК;
5.
антибиотики, подавляющие синтез пуринов
и аминокислот. К этой группе относятся,
например, сульфаниламиды.
Источники
антибиотиков.
Основными
продуцентами природных антибиотиков
являются микроорганизмы, которые,
находясь в своей естественной среде (в
основном, в почве), синтезируют антибиотики
в качестве средства выживания в борьбе
за существование. Животные и растительные
клетки также могут вырабатывать
некоторые вещества с селективным
антимикробным действием (например,
фитонциды), однако широкого применения
в медицине в качестве продуцентов
антибиотиков они не получили.
Таким
образом, основными источниками получения
природных и полусинтетических антибиотиков
стали:
• Актиномицеты(особенно
стрептомицеты) — ветвящиеся бактерии.
Они синтезируют большинство природных
антибиотиков (80 %).
• Плесневые
грибы—
синтезируют природные бета-лактамы
(грибы рода Cephalosporiumи
Penicillium)Hфузидиевую
кислоту.
• Типичные
бактерии—
например, эубактерии, бациллы, псевдомонады
— продуцируют бацитрацин, полимиксины
и другие вещества, обладающие
антибактериальным действием.
Способы
получения.
Существует
три основных способа получения
антибиотиков:
• биологическийсинтез
(так получают природные антибиотики
— натуральные продукты ферментации,
когда в оптимальных условиях
культивируют микробы-продуценты, которые
выделяют антибиотики в процессе своей
жизнедеятельности);
• биосинтезс
последующими химическими
модификациями(так
создают полусинтетические антибиотики).
Сначала путем биосинтеза получают
природный антибиотик, а затем его
первоначальную молекулу видоизменяют
путем химических модификаций, например
присоединяют определенные радикалы,
в результате чего улучшаются
противомикробные и фармакологические
характеристики препарата;
• химическийсинтез
(так получают синтетические аналоги
природных
антибиотиков, например
хлорамфеникол/левомицетин). Это вещества,
которые имеют такую же структуру,
46.
Механизмы устойчивости микробов к
лекарственным препаратам. Пути преодоления
устойчивости. Методы определения
чувствительности микробов к антибиотикам
и другим антимикробным веществам.
Основные критерии эффективности
антибиотикотерапии. Осложнения при
антибиотикотерапии.
Антибиотикорезистентность
— это устойчивость микробов к
антимикробным химиопрепаратам. Бактерии
следует считать резистентными, если
они не обезвреживаются такими
концентрациями препарата, которые
реально создаются в макроорганизме.
Резистентность может быть природной и
приобретенной.
Природная
устойчивость.
Некоторые виды микробов природно
устойчивы к определенным семействам
антибиотиков или в результате
отсутствия соответствующей мишени
(например, микоплазмы не имеют клеточной
стенки, поэтому не чувствительны ко
всем препаратам, действующим на этом
уровне), или в
результате
бактериальной непроницаемости для
данного препарата (например,
грамотрицательные микробы менее
проницаемы для крупномолекулярных
соединений, чем грамположительные
бактерии, так как их наружная мембрана
имеет «маленькие» поры).
Приобретенная
устойчивость.
Приобретение резистентности — это
биологическая закономерность, связанная
с адаптацией микроорганизмов к условиям
внешней среды. Она, хотя и в разной
степени, справедлива для всех бактерий
и всех антибиотиков. К химиопрепаратам
адаптируются не только бактерии, но и
остальные
микробы — от эукариотических форм
(простейшие, грибы) до вирусов. Проблема
формирования и распространения
лекарственной резистентности микробов
особенно значима для внутрибольничных
инфекций, вызываемых так называемыми
«госпитальными штаммами», у которых,
как правило, наблюдается множественная
устойчивость к антибиотикам (так
называемая полирезистентность).
Генетические
основы приобретенной резистентности.
Устойчивость к антибиотикам определяется
и поддерживается генами резистентности
(r-генами)
и условиями, способствующими их
распространению в микробных популяциях.
Приобретенная лекарственная устойчивость
может возникать и распространяться в
популяции бактерий в результате:
• мутаций
в хромосоме бактериальной клетки с
последующей
селекцией (т.
е. отбором) мутантов.
Особенно
легко селекция происходит в присутствии
антибиотиков, так как в
этих
условиях мутанты получают преимущество
перед остальными клетками популяции,
которые чувствительны к препарату.
Мутации возникают независимо от
применения антибиотика, т. е. сам
препарат не влияет на частоту мутаций
и не является их причиной, но
служит
фактором отбора. Далее резистентные
клетки дают потомство и могут передаваться
в организм следующего хозяина (человека
или животного), формируя и распространяя
резистентные штаммы. Мутации могут
быть: 1) единичные (если мутация произошла
в одной клетке, в результате чего в ней
синтезируются измененные белки) и 2)
множественные (серия мутаций, в
результате чего изменяется не один, а
целый набор белков, например
пени-циллинсвязывающих белков у
пенициллин-резистентного пневмококка);
• переноса
трансмиссивных плазмид резистентности
(R-плазмид).
Плазмиды
резистентности (трансмиссивные)
обычно кодируют перекрестную устойчивость
к нескольким семействам антибиотиков.
Впервые такая множественная резистентность
была описана японскими исследователями
в отношении кишечных бактерий. Сейчас
показано, что она встречается и у других
групп бактерий. Некоторые плазмиды
могут передаваться между бактериями
разных видов, поэтому один и тот же ген
резистентности можно встретить у
бактерий, таксономически далеких друг
от друга. Например, бета-лактамаза,
кодируемая плазмидой ТЕМ-1, широко
распространена у
грамотрицательных
бактерий и встречается у
кишечной
палочки и других кишечных бактерий,
а также у гонококка, резистентного к
пенициллину,
и гемофильной палочки, резистентной
к ампициллину;
• переноса
транспозонов, несущих r-гены
(или
мигрирующих генетических
последовательностей). Транспозоны
могут мигрировать с хромосомы на плазмиду
и обратно, а также с плазмиды на другую
плазмиду. Таким образом гены резистентности
могут передаваться далее дочерним
клеткам или при рекомбинации другим
бактериям-реципиентам.
Реализация
приобретенной устойчивости.
Изменения в геноме бактерий приводят
к тому, что меняются и некоторые свойства
бактериальной клетки, в результате чего
она становится устойчивой к антибактериальным
препаратам. Обычно антимикробный эффект
препарата осуществляется таким образом:
агент должен связаться с бактерией и
пройти сквозь ее оболочку, затем он
должен быть доставлен к месту действия,
после чего препарат взаимодействует
с внутриклеточными мишенями. Реализация
приобретенной лекарственной
устойчивости возможна на каждом из
следующих этапов:
• модификация
мишени. Фермент-мишень
может быть так изменен, что его функции
не нарушаются, но способность связываться
с химиопрепаратом (аффинность) резко
снижается или может быть включен
«обходной путь» метаболизма, т. е. в
клетке активируется другой фермент,
который не подвержен действию данного
препарата.
• «недоступность»
мишени за
счет снижения проницаемости
клеточной
стенки и клеточных мембран или
«эффлюко-механизма,
когда
клетка как бы «выталкивает» из себя
антибиотик.
• инактивация
препарата бактериальными ферментами.
Некоторые
бактерии способны продуцировать особые
ферменты, которые делают препараты
неактивными (например, бета-лактамазы,
аминогликозид-модифицирующие ферменты,
хлорамфениколацетилтрансфераза).
Бета-лактамазы — это ферменты, разрушающие
бета-лактамное кольцо с образованием
неактивных соединений. Гены, кодирующие
эти ферменты, широко распространены
среди бактерий и могут быть как в составе
хромосомы, так и в составе плазмиды.
Для
борьбы с инактивирующим действием
бета-лактамаз используют вещества —
ингибиторы (например, клавулановую
кислоту, сульбактам, тазобактам). Эти
вещества содержат в своем составе
бета-лактамное кольцо и способны
связываться с бета-лактамазами,
предотвращая их разрушительное
действие на бета-лактамы. При этом
собственная антибактериальная активность
таких ингибиторов низкая. Клавулановая
кислота ингибирует большинство
известныхбета-лактамаз. Ее комбинируют
с пеницил-линами: амоксициллином,
тикарциллином, пиперациллином.
Предупредить
развитие антибиотикорезистентности у
бактерий практически невозможно, но
необходимо использовать антимикробные
препараты таким образом, чтобы не
способствовать развитию и распространению
устойчивости (в частности, применять
антибиотики строго по показаниям,
избегать их использования с профилактической
целью, через 10—15 дней ан-тибиотикотерапии
менять препарат, по возможности
использовать препараты узкого спектра
действия, ограниченно применять
антибиотики в ветеринарии и не
использовать их как фактор роста).
Как
и всякие лекарственные средства,
практически каждая группа антимикробных
химиопрепаратов может оказывать побочное
действие, причем и на макроорганизм, и
на
микробы,
и на другие лекарственные средства.
Осложнения
со стороны макроорганизма
Наиболее
частыми осложнениями антимикробной
химиотерапии являются:
Токсическое
действие препаратов.
Как правило, развитие этого осложнения
зависит от свойств самого препарата,
его дозы, способа введения, состояния
больного и проявляется только при
длительном и систематическом
применении антимикробных химиотерапевтических
препаратов, когда создаются условия
для их накопления в организме. Особенно
часто такие осложнения бывают, когда
мишенью действия препарата являются
процессы или структуры, близкие по
составу или строению к аналогичным
структурам клеток макроорганизма.
Токсическому действию антимикробных
препаратов особенно подвержены дети,
беременные, а также пациенты с нарушением
функций печени, почек.
Побочное
токсическое влияние может проявляться
как нейротоксическое (например,
гликопептиды и аминогликозиды оказывают
ототоксическое действие, вплоть до
полной потери слуха за счет воздействия
на слуховой нерв); нефротоксическое
(полиены, полипептиды, аминогликозиды,
макролиды, гликопептиды, сульфаниламиды);
общетоксическое (противогрибковые
препараты — полиены, имидазолы); угнетение
кроветворения (тетрациклины,
сульфаниламиды, левомицетин/хлорамфеникол,
который содержит нитробензен — супрессор
функции костного мозга); тератогенное
[аминогликозиды, тетрациклины нарушают
развитие костей, хрящей у плода и детей,
формирование зубной эмали (коричневая
окраска зубов), левомицетин/хлорамфеникол
токсичен для новорожденных, у которых
ферменты печени не полностью сформированы
(«синдром серого ребенка»), хинолоны —
действуют на развивающуюся хрящевую
и соединительную ткани].
Предупреждение
осложнений состоит в отказе от
противопоказанных данному пациенту
препаратов, контроле за состоянием
функций печени, почек и т. п.
Дисбиоз
(дисбактериоз).
Антимикробные химиопрепараты, особенно
широкого спектра, могут воздействовать
не только на возбудителей инфекций, но
и на чувствительные микроорганизмы
нормальной микрофлоры. В результате
формируется дисбиоз, поэтому нарушаются
функции ЖКТ, возникает авитаминоз и
может развиться вторичная инфекция
(в том числе эндогенная, например
кандидоз, псевдомембранозный колит).
Предупреждение
последствий такого рода осложнений
состоит в назначении, по возможности,
препаратов узкого спектра действия,
сочетании лечения основного заболевания
с противогрибковой терапией (например,
назначением нистатина), витаминотерапей,
применением эубиотиков и т. п.
Отрицательное
воздействие на иммунную систему. К
этой
группе осложнений относят прежде
всего аллергические реакции. Причинами
развития гиперчувствительности может
быть сам препарат, продукты его распада,
а также комплекс препарата с сыворото㕇ными
белками. Возникновение такого рода
осложнений зависит от свойств самого
препарата, от способа и кратности
его введения, индивидуальной
чувствительности пациента к препарату.
Аллергические реакции развиваются
примерно в 10 % случаев и проявляются
в виде сыпи, зуда, крапивницы, отека
Квинке. Относительно редко встречается
такая тяжелая форма проявления
аллергии, как анафилактический шок.
Такое осложнение чаще дают бета-лактамы
(пенициллины), рифамицины. Сульфаниламиды
могут вызвать гиперчувствительность
замедленного типа. Предупреждение
осложнений состоит в тщательном
сборе аллергоанамнеза и назначении
препаратов в соответствии с индивидуальной
чувствительностью пациента. Кроме того,
антибиотики обладают некоторым
иммунодепрессивным действием и могут
способствовать развитию вторичного
иммунодефицита и ослаблению напряженности
иммунитета.
Эндотоксический
шок (терапевтический). Это
явление, которое возникает при лечении
инфекций, вызванных грамотрицательными
бактериями. Введение антибиотиков
вызывает гибель и разрушение клеток и
высвобождение больших количеств
эндотоксина. Это закономерное явление,
которое сопровождается временным
ухудшением клинического состояния
больного.
Взаимодействие
с другими препаратами. Антибиотики
могут способствовать потенцированию
действия или инактивации других
препаратов (например, эритромицин
стимулирует выработку ферментов
печени, которые начинают ускоренно
метаболизировать лекарственные
средства разного назначения).
Побочное
воздействие на микроорганизмы.
Применение
антимикробных химиопрепа-ратов оказывает
на микробы не только прямое угнетающее
или губительное воздействие, но также
может привести к формированию атипичных
форм микробов (например, к образованию
L-форм
бактерий или изменению других свойств
микробов, что значительно затрудняет
диагностику инфекционных заболеваний)
и персистирующих форм микробов. Широкое
использование антимикробных лекарственных
средств ведет также к формированию
антибиотикозависимости (редко) и
лекарственной устойчивости —
антибиотикорезистентности (достаточно
часто).
49
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
