Побочные действия лимонной кислоты

| Лимонная кислота | |
|---|---|
| Систематическое наименование | 2-гидроксипропан-1,2,3-трикарбоновая кислота |
| Традиционные названия | Лимонная кислота |
| Хим. формула | C6H8O7 |
| Молярная масса | 192,1 г/моль |
| Плотность | 1,665 г/см³ |
| Температура | |
| • плавления | 153 °C |
| • разложения | 175 °C |
| Константа диссоциации кислоты | 3,14[1] |
| Растворимость | |
| • в воде | 133 г/100 мл |
| Рег. номер CAS | 77-92-9 |
| PubChem | 311 |
| Рег. номер EINECS | 201-069-1 |
| SMILES | C(C(=O)O)C(CC(=O)O)(C(=O)O)O |
| InChI | 1S/C6H8O7/c7-3(8)1-6(13,5(11)12)2-4(9)10/h13H,1-2H2,(H,7,8)(H,9,10)(H,11,12) KRKNYBCHXYNGOX-UHFFFAOYSA-N |
| Кодекс Алиментариус | E330 |
| RTECS | GE7350000 |
| ChEBI | 30769 |
| Номер ООН | 1789 |
| ChemSpider | 305 |
| Краткие характер. опасности (H) | H319 |
| Меры предостор. (P) | P264, P280, P305+P351+P338, P337+P313 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС | |
| NFPA 704 | 1 2 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Лимо́нная кислота́ (систематическое название 2-гидроксипропан-1,2,3-трикарбоновая кислота или 3-гидрокси-3-карбоксипентандиовая) или — трёхосновная карбоновая кислота.
Кристаллическое вещество белого цвета, температура плавления 153 °C. Хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Является слабой кислотой. Соли и сложные эфиры лимонной кислоты называют цитратами.
Открытие[править | править код]
Открытие лимонной кислоты приписывают арабскому алхимику Джабиру ибн Хайяну. Выделить её впервые удалось шведскому аптекарю Карлу Шееле. В 1784 году он осадил её в виде цитрата кальция из лимонного сока.
В 1838 году Юстус фон Либих установил, что в молекуле лимонной кислоты присутствует одна гидроксильная группа и три карбоксильные группы. Собственно лимонная кислота в чистом виде была получена из цитрата кальция в 1860 году в Англии[2][3].
Физические свойства[править | править код]
Кристаллы лимонной кислоты под микроскопом между скрещённых поляроидов. Радужные цвета обусловлены разным вращением плоскости поляризации света для различных длин волн. Увеличение 200х.
Лимонная кислота представляет собой кристаллическое вещество без цвета и запаха, имеющее сильный кислый вкус. Ниже 36,6 °С она кристаллизуется из водного раствора в виде моногидрата, который имеет плотность 1,542 г/см3 и плавится при 100 °С. Его кристаллы имеют орторомбическую сингонию. Безводная лимонная кислота имеет относительную плотность 1,665 г/см3 и плавится при 153 °С.
Моногидрат кристаллизуется в моноклинной сингонии. Перевести моногидрат в безводную форму можно в вакууме в присутствии серной кислоты. В безводном виде гигроскопична и поглощает влагу из воздуха[4].
Химические свойства[править | править код]
При нагревании выше 175 °C лимонная кислота переходит в аконитовую кислоту, а при сухой перегонке отщепляется вода и декарбоксилируется, одновременно образуя ацетон, и даёт ангидриды итаконовой и цитраконовой кислот. Окисление перманганатом калия при 35 °С приводит к ацетондикарбоновой кислоте, а при 85 °С — к щавелевой кислоте. При плавлении с гидроксидом калия лимонная кислота образует щавелевую кислоту и уксусную кислоту[5].
Концентрация ионов при электролитической диссоциации водных растворов лимонной кислоты при разных pH. A — остаток молекулы кислоты.
— недиссоциированная молекула;
— однозарядный ион;
— двухзарядный ион;
— трёхзарядный ион.
Лимонная кислота является слабой трёхосновной кислотой, образует три ряда солей, в растворе подвергается многоступенчатой электролитической диссоциации. Константы диссоциации (в воде при 18 °C) равны:
К1 = 8,2⋅10−4;
K2 = 1,8⋅10−5;
K3 = 4,0⋅10−6[4].
В водном растворе лимонная кислота образует хелатные комплексы с ионами кальция, магния, меди, железа и другими. Иногда в комплексообразовании участвует не одна молекула лимонной кислоты[5].
Лимонная кислота образует сложные эфиры со спиртами в присутствии обычных кислотных катализаторов (серная кислота, пара-толуолсульфокислота, ионообменные смолы) либо без катализатора (с высококипящими спиртами). Некоторые эфиры, например, Триметилцитрат, триэтилцитрат и трибутилцитрат используются в качестве пластификаторов. С двухатомными и многоатомными спиртами лимонная кислота образует полиэфиры[6].
Гидроксильная группа лимонной кислоты при обработке хлорангидридами органических кислот и ангидридами кислот может участвовать в образовании сложных эфиров, а также взаимодействует с эпоксидами[6].
Получение[править | править код]
В промышленности[править | править код]
С середины 1800-х гг. лимонную кислоту получали исключительно из сока недозревших лимонов, смешивая его с негашёной известью и осаждая таким образом плохорастворимый цитрат кальция. Обработка цитрата кальция серной кислотой приводит к образованию осадка сульфата кальция, а из надосадочной жидкости кристаллизацией выделяли лимонную кислоту. Выход такого процесса составлял 2—3 масс. % от сухой массы фруктов[6]. В литературе упоминается, что лимонную кислоту в виде кальциевой соли развозили из Сицилии и Южной Италии к местам потребления (преимущественно в Англию, Францию и США), а саму кислоту выделяли уже на месте[7].
В 1893 году был обнаружен первый ферментативный метод получения лимонной кислоты: немецкий химик и миколог Карл Вемер использовал для этого плесневые грибы рода пеницилл. Однако внедрить метод в промышленность не удавалось из-за проблем с очисткой продукта. Успех был достигнут лишь в 1919 году, когда ферментативный процесс был организован в Бельгии. Перевес в пользу ферментативного получения произошёл после Первой мировой войны, когда возникли проблемы с поставкой лимонной кислоты из Италии, а мировые потребности всё более нарастали. В 1923 году фирма Пфайзер коммерциализировала открытый ранее Джеймсом Карри и Чарлзом Том процесс превращения углеводов в лимонную кислоту под действием плесневых грибов вида Aspergillus niger в присутствии небольшого количества неорганических солей[7].
По состоянию на начало ХХІ в. весь объём промышленной лимонной кислоты производится биосинтезом. В качестве сырья используют гидролизат кукурузы (в Северной и Южной Америке и Европе), гидролизат маниока, батата и кукурузы (в Азии), кристаллическую сахарозу (в Южной Америке) и мелассу (в Азии и Европе). В некоторых случаях лимонную кислоту получают из сельскохозяйственных отходов[6].
Этот процесс используется с 1930-х гг. Теоретически, из 100 кг сахарозы можно получить 123 кг моногидрата лимонной кислоты либо 112 кг безводной лимонной кислоты. Фактически выход ниже так как грибки потребляют часть сахарозы для собственного роста и дыхания. Реальный выход составляет от 60 до 85 % от теоретического. Ферментативный процесс можно проводить в трёх типах:
- твердофазная ферментация;
- поверхностная ферментация;
- глубинная ферментация[8].
При твердофазной ферментации сырьё помещается в желоба́ и смачивается водой. При необходимости в воду добавляют питательные вещества, и затем туда помещают грибковую культуру. После окончания процесса лимонную кислоту вымывают водой, выделяют из раствора и очищают.
Поверхностную ферментацию проводят на специальных лотках, куда помещают субстрат и некоторые неорганические питательные вещества. pH среды регулируют в диапазоне 3—7 pH в зависимости от вида субстрата, затем проводят стерилизацию и устанавливают необходимую температуру. Затем на лотки наносят культуру грибков, которые размножается и покрывает всю поверхность субстрата, после чего начинается образование лимонной кислоты. По окончании процесса из жидкости выделяют лимонную кислоту.
Глубинная ферментация проводится в больших ёмкостях в два этапа. Сначала 10 % субстрата ферментируют в течение 1 дня в качестве затравки, после чего смесь добавляют в основную массу и ферментируют в течение 3—7 дней. Процесс проводится при постоянной продувки жидкости воздухом с помощью компрессора[8].
После ферментации жидкость фильтруют через мембрану и отделяют лимонную кислоту от белков и остаточных углеводов негашёной известью, экстракцией или хроматографией. По первому, наиболее распространённому способу, лимонная кислота осаждается в виде кальциевой соли, которую затем обрабатывают серной кислотой, получая нерастворимый гипс и раствор очищенной лимонной кислоты. Второй способ основан на использовании специфичного растворителя, в котором лимонная кислота растворяется лучше, чем примеси.
Хроматографическая очистка основана на использовании анионитов: лимонная кислота сорбируется на носителе, а затем вымывается из сорбента разбавленной серной кислотой[9].
После выделения проводят очистку. Для этого загрязнённую лимонную кислоту обрабатывают активированным углём для удаления окрашенных примесей, пропускают через слой ионообменных смол для удаления растворимых солей, фильтруют от нерастворимых примесей и кристаллизуют[8].
В 2012 году мировой объём производства лимонной кислоты составил приблизительно 1,6 млн тонн, из них примерно 0,8—0,9 млн тонн произведено в Китае. Около 70 % от общего производства используется в пищевой промышленности[8].
Лабораторный синтез[править | править код]
В классический лабораторном синтезе лимонной кислоты в качестве исходного вещества применяют ацетон, который бромируют по метильным группам, затем производят реакцию с циановодородом и гидролизуют[6].
Полный синтез[править | править код]
Впервые лимонную кислоту химическим синтезом получили Гримо (Grimaux) и Адам (Adam) в 1880 году. Исходным соединением в этом синтезе послужил глицерин. Первичные гидроксильные группы молекулы глицерина сначала замещали на атомы хлора, а затем на нитрильные группы, которые при гидролизе давали концевые карбоксильные группы. Вторичную же гидроксильную группу окисляли до кетогруппы, к которой затем присоединяли циановодород; полученный циангидрин также при гидролизе давал карбоксильную группу[10].
Другой подход был предложен в 1890 году. Он был основан на превращении ацетоуксусного эфира, который хлорировали, как предполагалось, по концевому α-положению, затем вводили в то же положение нитрильную группу, которую в итоге гидролизовали до карбоксильной группы. На последней стадии создавали заместители при атоме С2, получая циангидрин и гидролизуя его в кислой среде. Схема этого полного синтеза была подвергнута сомнению: некоторые химики, например, Шарль Прево, высказали предположение, что хлорируется не концевое α-положение ацетоуксусного эфира, а среднее, из-за чего образуется не сама лимонная кислота, а её изомер. Дискуссия, как предполагается, возникла из-за того, что в конце XIX в. ещё не существовало спектроскопических методов, которые позволили бы заметить эту разницу[11].
В 1891 году лимонную кислоту получили присоединением синильной кислоты к моноэтиловому эфиру ацетондикарбоновой кислоты с последующим гидролизом. Правда, само исходное вещество было изначально получено из лимонной кислоты[12].
В 1897 году был предложен подход к синтезу лимонной кислоты, основанный на недавно открытой реакции Реформатского (1895). Согласно этому методу, в реакцию вводились этилбромацетат и диэтилоксалоацетат в присутствии цинка[13].
Из более поздних подходов можно отметить предложенное в 1973 году превращение щавелевоуксусной кислоты, которая при самоконденсации с декарбоксилированием давала цитроилмуравьиную кислоту. Последнюю затем в присутствии пероксида водорода или трет-бутилгидропероксида превращали в лимонную кислоту[14][15].
В 1980 году лимонную кислоту получили по реакции конденсации 3-метилбутен-3-ола-1 и формальдегида с последующим окислением полученного продукта диоксидом азота[16][15].
Нахождение в природе[править | править код]
Лимонная кислота содержится в различных фруктах, в большом количестве — в цитрусовых (примерно до 5 % в плодах и до 9 % в соке). В 100 г лайма содержится 7 г лимонной кислоты; лимона — 5,6 г; малины — 2,5 г; чёрной смородины — 1,2 г; помидоров — 1,0 г; ананаса и клубники — 0,6 г; клюквы — 0,2 г; яблока — 14 мг[3].
Лимонная кислота участвует в цикле трикарбоновых кислот — основном процессе дыхания клетки, поэтому в некоторой заметной концентрации она содержится в организме всех животных и растениях[3].
Применение[править | править код]
Сама кислота, как и её соли (цитрат натрия, цитрат калия, цитрат кальция, дицитрат трикалия висмута), широко используется как вкусовая добавка, регулятор кислотности и консервант в пищевой промышленности (пищевые добавки E330—Е333), в производстве плавленых сыров, напитков, сухих смесей для приготовления шипучих напитков.
Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен в цикле Кребса. При приёме внутрь в небольших дозах, например, при употреблении плодов цитрусовых активирует цикл Кребса в организме, что способствует ускорению метаболизма.
В косметике используется как регулятор кислотности косметических средств, в качестве буферных растворов, хелатирующий агент, в смесях для приготовления «шипучих» ванн.
В нефтяной добыче при бурении нефтяных и газовых скважин используется для снижения pH бурового раствора после щелочных ванн.
В строительстве лимонную кислоту применяют в качестве добавки к цементному и гипсовому растворам для замедления схватывания[17][18].
Лимонная кислота может использоваться для травления слоя меди на печатных платах[19] в смеси с перекисью водорода.
Широко используется в бытовой химии в качестве очистительного средства нагревательных поверхностей, например, от накипи на дне чайника.
Влияние на здоровье[править | править код]
В конце 1970-х годов в Западной Европе получила распространение мистификация, известная как «вильжюифский список», в котором лимонная кислота была названа сильным канцерогеном[20]. В действительности же, при пищевом применении лимонная кислота считается безопасной добавкой.
Согласно европейскому законодательству, лимонную кислоту можно использовать в GMP без ограничений. Американская FDA определяет лимонную кислоту как GRAS (англ. generally recognized as safe и признаётся безопасной)[21].
Сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При единовременном употреблении внутрь больших количеств лимонной кислоты возможны раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей[22].
LD50 для крыс перорально: 3 г/кг.
Примечания[править | править код]
- ↑ Weast R. C. CRC Handbook of Chemistry and Physics (1st student edition) (англ.) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
- ↑ Apelblat, 2014, p. 1.
- ↑ 1 2 3 Ullmann, 2014, p. 1.
- ↑ 1 2 Ullmann, 2014, p. 2.
- ↑ 1 2 Ullmann, 2014, p. 3.
- ↑ 1 2 3 4 5 Ullmann, 2014, p. 4.
- ↑ 1 2 Apelblat, 2014, p. 2.
- ↑ 1 2 3 4 Ullmann, 2014, p. 4–6.
- ↑ Ullmann, 2014, p. 6–7.
- ↑ Apelblat, 2014, p. 213.
- ↑ Apelblat, 2014, p. 214–215.
- ↑ Apelblat, 2014, p. 216.
- ↑ Apelblat, 2014, p. 215.
- ↑ Wiley R. H., Kim K. S. Bimolecular decarboxylative self-condensation of oxaloacetic acid to citrolyformic acid and its conversion by oxidative decarboxylation to citric acid : [англ.] // J. Org. Chem.. — 1973. — Vol. 38, no. 20. — P. 3582–3585. — doi:10.1021/jo00960a030.
- ↑ 1 2 Apelblat, 2014, p. 216–217.
- ↑ Wilkes J. B., Wall R. G. Reaction of dinitrogen tetraoxide with hydrophilic olefins: synthesis of citric and 2-hydroxy-2-methylbutanedioic acids : [англ.] // J. Org. Chem.. — 1980. — Vol. 45, no. 2. — P. 247–250. — doi:10.1021/jo01290a008.
- ↑ Singh, N.B.; A.K. Singh, S. Prabha Singh. Effect of citric acid on the hydration of portland cement (англ.) // Cement and Concrete Research : journal. — 1986. — Vol. 16, no. 6. — P. 911—920. — ISSN 00088846. — doi:10.1016/0008-8846(86)90015-3.
- ↑ Козлова В. К., Карпова Ю. В., Вольф А. В. Оценка эффективности добавок, замедляющих схватывание цементного теста // Ползуновский вестник. — 2006. — Вып. №2—2. — С. 230—233.
- ↑ РадиоКот :: Безопасный общедоступный состав для травления меди в домашних условиях
- ↑ https://www.jstor.org/pss/2749354
- ↑ Ullmann, 2014, p. 8.
- ↑ Merck Safety Data Sheet — Citric acid (pdf)
Литература[править | править код]
- Apelblat A. Citric Acid. — Springer, 2014. — ISBN 978-3-319-11233-6. — doi:10.1007/978-3-319-11233-6.
- Verhoff F. H., Bauweleers H. Citric Acid (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2014. — doi:10.1002/14356007.a07_103.pub3.
Ссылки[править | править код]
- Лимонная кислота — обзор рынка, производство
- Лимонная кислота, как пищевая добавка
- Волков А. И., Жарский И. М. Большой химический справочник — Мн.: Современная школа
- ГОСТ 31726-2012. Добавки пищевые. Кислота лимонная безводная Е330. Технические условия
Современные технологи считают неэффективным старинный дорогостоящий способ выработки из цитрусовых плодов такого распространенного вещества, как лимонная кислота. Польза и вред синтезируемой в промышленных масштабах пищевой добавки Е330 — «лимонки» — зависит от многих факторов: цели и правил применения, а также здоровья человека.

Незаменимый продукт употребляется не только при приготовлении кулинарных шедевров и в косметологии, но также в лечебных целях и в быту. Кристаллический белый порошок лимонной кислоты в большинстве случаев полезен для организма человека, но при его употреблении необходимо соблюдать некоторые предосторожности.
Производство «лимонки» и ее химический состав
Впервые лимонная кислота (польза и вред от которой были изучены позднее) была выделена из сока плодов недозрелых цитрусовых шведским фармацевтом Карлом Шееле. Случилось это в 1784 году и с тех пор в науке это вещество носит название пищевой добавки Е330, но способ ее синтеза существенно изменился. Технология добывания лимонной кислоты из цитрусовых, стеблей табачных культур и хвои оказался очень затратным, а получаемое количество кристаллического порошка не позволяло достичь промышленных масштабов. Поэтому синтетический антиоксидант стали производить с помощью сахаросодержащих продуктов (сахарной свеклы или тростника, патоки) и специфических штаммов плесневых грибов — пенициллина и аспергилла.
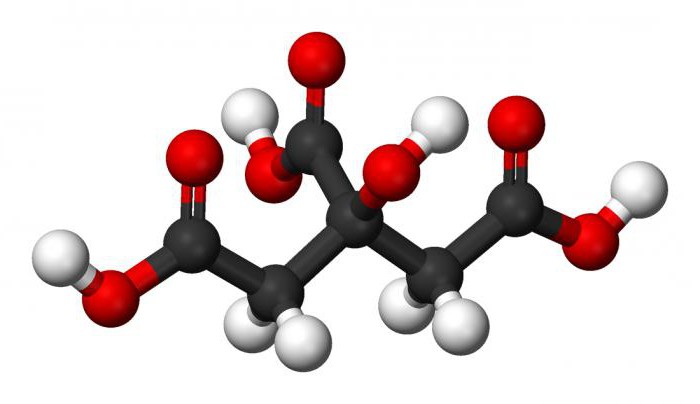
Продукт богат витаминами C, A и E, а также жизненно важными минералами – серой, фосфором и хлором. Химическое строение Е330 – трехосновная оксикарбоновая кислота, производные из которой – соли и эфиры – называют цитратами.
Свойства лимонной кислоты
Описываемая пищевая добавка легко растворяется в воде и этиловом спирте. При нагревании до высоких температур (более 175 градусов) распадается, выделяя углекислый газ и воду. Природный или синтетический антиоксидант — лимонная кислота — пользу и вред приносит в зависимости от цели и дозировки.

Белый кристаллический порошок обладает низким уровнем токсичности, в разумных количествах безвреден для организма и окружающей среды. В природе «лимонка» встречается в большинстве фруктов и овощей, ее легко узнать по кислому, немного терпкому вкусу.
В каких сферах находит применение?
В пищевой промышленности лимонную кислоту задействуют как ароматизатор, антиоксидант и консервант. Она помогает сохранять текстуру, вкус и внешний вид пищевых продуктов. Лимонная кислота, польза и вред которой сегодня досконально изучены, широко практикуется в изготовлении фруктовых джемов, соусов, желе, майонезов, кондитерских изделий, различных консервов и плавленых сыров. Благодаря кулинарным преимуществам, пищевая добавка Е330 используется в качестве: усилителя вкуса, придающего продуктам пикантную «кислинку»; природного консерванта, уничтожающего бактерии, грибки и плесень, а также нормализующего pH продуктов; добавки витамина C; маринада для мясных блюд, придающего нежность белковой структуре; облагораживающей вкус и снижающей кислотность вина.

Производители качественной косметики ценят лимонную кислоту за ее антиоксидантные свойства. Они помогают нормализовать уровень pH средств красоты (кремов и гелей), приблизив его к естественному балансу кожи; усилить антивозрастное действие косметических продуктов; оказать депигментирующий эффект на кожный покров; результативно бороться с акне и его последствиями.
В медицине лимонная кислота является компонентом средств, участвующих в цитратном цикле (Кребса) – центральной части процессов катаболизма, регулирующих ключевой этап дыхания клеток. Она помогает смягчать боль в горле при простуде и снижать остроту похмельного синдрома.
В быту лимонная кислота широко используется в качестве чистящего средства: ею можно до блеска отполировать чайник и стиральную машину от накипи, привести в порядок кухонные поверхности и серебро. Садоводы также рекомендуют добавлять ее в смеси при подкормке растений.
Лимонная кислота: польза и вред для человека
Лечебные свойства пищевой добавки Е330, или «лимонки», производят положительный эффект при самых разных недугах и ухудшении самочувствия человека. У многих людей зачастую вызывают удивления советы докторов, рекомендующие употреблять воду с добавлением лимонной кислоты при простуде для лечения и облегчения дискомфорта в горле; питье теплой воды с добавкой Е330, очищающей печень от токсинов за счет стимуляции желчеотделения, а также освобождающей кишечник от ядов и бактерий. Вода с лимонной кислотой (пользу и вред она может принести в зависимости от концентрации порошка в жидкости) способствует синтезу желчи, нормализует пищеварение.

Один стакан такого напитка, употребляемый ежедневно натощак, улучшает работу ЖКТ, избавляет от изжоги и запоров. Кроме того, вода с «лимонкой» очищает сосуды и артерии, служит хорошим дополнением к основному лечению у людей с гипертонией. Этот напиток при полоскании оказывает бактерицидное действие на полость рта, освежает дыхание, избавляет от различных микробов.
Для похудения
Диетологи довольно часто рекомендуют пациентам с целью снижения веса включать в рацион воду с лимонной кислотой. Пользу и вред для здоровья худеющих такой напиток может принести, если по-разному относиться к его употреблению: придерживаться или не соблюдать пропорции во время его приготовления; правильно питаться или не снижать количество вредной пищи, которая в избытке содержит соль, сахар и жиры; следить за своим самочувствием или игнорировать противопоказания.
Если же употреблять «лимонку» в растворенном виде натощак, то она поможет снизить аппетит и повысить вязкость слюны, запустить метаболизм, нормализовать работу желудка и очистить печень. При этом калорийность лимонной кислоты равна 1 ккал на 100 г продукта! Ее гликемический индекс низок, он не превышает 15 единиц. Детокс-напиток приготовить очень просто, отжав сок одного лимона на 1000-1500 мл воды или добавив 5-10 г кристаллов лимонной кислоты. Усилить действие очищающего коктейля поможет кусочек измельченного корня имбиря, свежая мята и мелисса.
В косметологии
Людям с проблемной жирной кожей и расширенными порами на лице лимонная кислота (польза и вред в этом случае обусловлена ее концентрацией) в составе маски или раствора для протирания кожного покрова (2-3%) помогает выровнять цвет лица, придав ему естественный матовый оттенок, сузить поры, улучшив текстуру поверхности кожи, а также очистить ее, сделав нежной и приятной на ощупь. Для приготовления маски-пилинга для лица с «лимонкой» достаточно маленькой щепотки вещества на кончике ножа.
Кроме того, волосы становятся послушными при расчесывании и возвращают здоровое сияние, если ополаскивать их подкисленной водой (слабым раствором лимонной кислоты из 0,5 чайной ложки кристаллов на 1000 мл воды) после мытья с применением шампуня. Это средство также полезно для здоровья и улучшения вида ногтевых пластин: они становятся гладкими, блестящими. Но слишком часто использовать «лимонку» в косметологии нельзя, ее применяют курсами для решения той или иной эстетической задачи, а затем делают перерыв.
Беременным женщинам и кормящим матерям, детям и пожилым людям
Что приносит будущим мамам лимонная кислота — пользу для организма или вред? На фоне запрета большинства медицинских препаратов при простуде чай с умеренным количеством лимонной кислоты (или натуральным соком лимона) будет действовать оздоравливающе на беременную женщину и плод.

Напиток из воды и нескольких кристалликов лимонной кислоты может стать незаменимым средством для снятия отеков с конечностей во время вынашивания ребенка и после родов. Кроме того, «лимонка» нормализует работу кишечника, улучшает работу иммунной системы и деликатно помогает организму в выработке лактозы. Если упаковка детского питания маркирована пищевой добавкой Е330, и у ребенка отсутствует аллергия на лимонную кислоту, то нет причины для беспокойства. Однако превышать суточную дозу данного вещества, составляющую примерно 50-60 мг на 1 кг веса малыша, не стоит. Если ребенок случайно съел много кристаллов лимонной кислоты, то ему необходимо срочно промыть желудок и вызвать неотложку.
В пожилом возрасте человеку напиток с лимонной кислотой помогает улучшить зрение, придает сил, снимает дискомфорт в суставах, предотвращает процесс тромбообразования, является хорошей профилактикой варикоза. При сахарном диабете теплый напиток из воды с «лимонкой» заметно снижает уровень глюкозы в крови.
Противопоказания и вред «лимонки» при неправильном использовании
Специалисты рекомендуют прежде, чем приступить к регулярному употреблению пищевой лимонной кислоты, пользу и вред подобной практики обсудить с лечащим врачом, а также пройти обследование, чтобы убедиться в отсутствии проблем с ЖКТ. Безвредный порошок у людей с желудочными заболеваниями может спровоцировать ухудшение состояния. Неправильно приготовленные растворы с большой концентрацией лимонной кислоты способны вызывать у человека боль в желудке, рвоту и кашель.
Известно, что кристаллический порошок «лимонки» при попадании на слизистые оболочки глаз и других органов наносит существенный вред, вызывая их повреждение. В целях безопасности необходимо строго соблюдать слабую дозировку вещества, указанную в рецептах. Самостоятельно увеличивать концентрацию лимонной кислоты нельзя, так как это может привести к раздражению слизистой оболочки желудка и нарушению ее целостности, появлению спазмов, болей в животе, тошноты и рвоты, диареи, повышенной потливости и лихорадки, стула с кровью, учащения позывов к мочеиспусканию, головной боли, повышению АД, слабости, нервозности и отекам.
Длительное употребление лимонной кислоты негативно сказывается на структуре зубной эмали, вызывая ее постепенное разрушение. Регулярное и бесконтрольное раздражение оболочки желудка крепким раствором «лимонки» также может привести к появлению гастрита и язвы. Необходимо строго следить за своим самочувствием во время применения лимонной кислоты, придерживаться суточной дозировки, при появлении малейшего дискомфорта прием напитка с данным продуктом прекратить.
