Противопоказания для искусственного кровообращения

Коронарный кровоток
Правая и левая коронарные артерии отходят от переднего и левого аортальных синусов соответственно, прямо над створками аортального клапана.
Правая коронарная артерия спускается по правой атриовентрикулярной (АВ) борозде, продолжается вокруг нижней границы сердца и соединяется с огибающей ветвью левой коронарной артерии в области задней атриовентрикулярной борозды. В этом месте отходят острые краевые ветви, кровоснабжающие низ сердца и правый желудочек. Приблизительно у 85% людей они завершаются в виде задней нисходящей артерии, снабжающей задненижний отдел левого желудочка и межжелудочковую перегородку. Это описывается как правая доминирующая система.
Левая коронарная артерия выходит из левого аортального синуса в виде левого главного ствола, сзади от легочного ствола и вскоре разделяется на левую переднюю нисходящую и огибающую артерии. Левая передняя нисходящая артерия спускается вниз по передней межжелудочковой борозде и огибает верхушку, давая начало септальным и диагональным ветвям, которые снабжают соответственно перегородку и свободную стенку левого желудочка. Эти ветви — важные ориентиры при описании поражений левой передней нисходящей артерии.
Огибающая артерия идет по левой АВ-борозде, снабжая свободную боковую стенку левого желудочка через ветви тупого конца, числом от одной до трех, и в 15% случаев образуя заднюю нисходящую артерию, левую доминирующую систему. Кардинально это означает, что левая коронарная артерия снабжает полностью левый желудочек, межжелудочковую перегородку (АВ-узел кровоснабжается из ПКА).
- 75% миокардиального венозного возврата происходит в правое предсердие через коронарный синус в задней АВ-борозде, 20% возврата через переднюю кардиальную вену.
- 5% миокардиального венозного возврат дренируется непосредственно в левый желудочек через малые сердечные (тебезиевы) вены, передние синусоидальные и передние просветные вены. Они представляют собой постоянный шунт и вносят вклад в разбавление оксигенированной крови.
- Коронарный кровоток в покое — 250 мл/мин или 5% сердечного выброса с экстракцией кислорода, близкой к максимальной.
- При нагрузке кровоток может увеличиваться в пять раз, преимущественно под контролем метаболической ауторегуляции. Аденозин, образующийся при распаде АТФ, и гипоксия – главные сосудорасширяющие средства.
- Коронарный кровоток в левом желудочке происходит только во время диастолы.
- Давление в правом желудочке 25 мм рт. ст. минимально нарушает ток крови в право/ коронарной артерии, в то время как крою- ток в левой коронарной артерии может останавливаться и, возможно, даже поворачивать вспять при повышении давления в левом желудочке более 120 мм рт. ст.
- Тахикардия сокращает время диастолы и, в конечном счете, уменьшает коронарный кровоток. Частота сердцебиений 90-100 уд./мин обычно оптимизирует коронарный кровоток и, соответственно, сердечный выброс.
Искусственное кровообращение
Искусственное кровообращение (ИК) замещает работу сердца и легких, пока сердце остановлено, обеспечивая бескровное и стабильное хирургическое поле. Аппарат искусственного кровообращения (АИК) состоит из присоединяемого одноразового модуля, включающего в себя резервуар, оксигенатор и теплообменник, связанного через ряд роликовых насосов с основной частью машины.
В основном используют мембранные оксигенаторы. Они содержат пучки мельчайших трубочек, сходные с теми, которые используются для гемофильтрации, создавая большую площадь поверхности для газообмена (2-2,5 м2). Газообмен происходит по градиенту концентрации; увеличение газового потока увеличивает экстракцию СО2, а увеличение FiО2 увеличивает насыщение крови кислородом.
До начала ИК необходимо провести антикоагуляционную терапию, чтобы АВС составляло больше 400 с. Кровь поступает из нижней полой вены и верхней полой вены в резервуар, где фильтруется и очищается от пены. Затем она перекачивается через теплообменник, где достигает требуемой температуры, и через оксигенатор возвращается к пациенту через узкую аортальную канюлю, установленную в луковицу аорты. Контур АИК заполняют 1000 мл кристаллоидного раствора (раствор Хартманна) с 5000 ЕД гепарина и иногда маннитола (0,5 г/кг). АИК в норме создает непульсирующий поток с сердечным индексом 2,4 л/мин/м2.
Перфузиолог может управлять средним артериальным давлением (САД), регулируя скорость насоса и при помощи вазопрессоров/ вазодилататоров. САД обычно поддерживают между 50 и 70 мм рт. ст. Объем, необходимый для поддержания гематокрита на уровне 20- 30%, может быть добавлен в резервуар (коллоиды, кровь) или удален с помощью ультрафильтрации. Медикаменты могут также быть добавлены в контур.
Искусственное кровообращение вызывает гемолиз, повреждение тромбоцитов и расход факторов свертывания крови. Это обычно минимально в первые 2 ч. Отсасывание из операционной раны непосредственно в резервуар и разрежение при отсасывании могут усилить гемолиз. Другие потенциальные проблемы включают слабый венозный возврат, расслоение аорты и газовую эмболию.
Риск ОНМК достигает 1-5% и связан с несколькими факторами:
- Возраст
- Атерома аорты
- ОНМК в анамнезе
- Сахарный диабет
- Тип операции (замена дуги аорты > замена клапанов > операция на коронарных артериях).
Нарушения ментальных функций часто встречаются (до 80% всех пациентов) в послеоперационном периоде и сохраняются у 30% пациентов. Они вызваны микроэмболиями (тромбоциты, атерома и т. д.).
Подключение аппарата искусственного кровообращения
- Перед катетеризацией систолическое давление должно быть снижено (до 80-100 мм рт. ст.), чтобы уменьшить риск расслоения аорты.
- До подключения АИК пациенту необходимо вести антикоагулянты — гепарин 300 ЕД/кг (обычная доза составляет 20 000-25 000 ЕД). АВС должно быть лабораторно подтверждено на уровне > 400 с.
- Создают и поддерживают давление кардиоплегии до 300 мм рт. ст., гарантируя отсутствие пузырьков в контуре, если используется холодовая кардиоплегия.
- Когда пациент подключен к АИК, вентилятор выключают и начинают введение внутривенного анестетика (пропофол 6 мг/кг/ч). Болюсное введение мидазолама или испаритель, установленный на АИК, служат альтернативой.
- Перфузиолог обеспечивает давление перфузии 50-70 мм рт. ст., изменяя приток/возврат и используя а-блокаторы типа метараминола.
- Газы крови и активированное время тромбообразования контролируют каждые 30 мин.
- Температуру пациента понижают активно или позволяют ей снижаться самостоятельно до 28-34 °С, в зависимости от типа операции и предпочтений хирурга.
Отключение от АИК
Это — совместные действия хирурга, анестезиолога и перфузиолога. Цель состоит в том, чтобы, отключая пациента от АИК, позволить сердцу и легким восстановить нормальную физиологическую функцию.
- Прежде чем отключать от АИК:
- Температура должна быть вновь повышена до 37 °С
- Калий должен быть 4-5 ммоль/л
- Гематокрит должен быть > 24%.
- Готовят протамин из расчета 1 мг/100 ЕД гепарина — обычно 3 мг/кг.
- Венозную линию прогрессивно пережимают, и сердце постепенно получает возможность заполниться и выталкивать кровь. Обычная практика — при отключении аппарата оставлять пациента относительно «недовосполненным». Это позволяет избежать перерастяжения желудочков, которые все же еще не могут нормально функционировать.
- Перфузиолог переливает растворы болюсно по 100 мл по мере необходимости. Необходимо внимательно наблюдать за сердечной деятельностью и наполнением. Если желудочек сокращается слабо, то начинают введение адреналина в малых дозах.
- Частота сердечных сокращений должна быть 70-100 уд./мин, ритм синусовый (если возможно). Используют дефибрилляцию и атропин/изопреналин/адреналин по мере необходимости.
- Вентилируют 100% кислородом, необходимо обеспечить расправление легких.
- Когда хирург просит ввести протамин, четко информируют перфузиолога о прекращении забора из вены и вводят в/в медленно. Если системное артериальное давление уменьшится вследствие вазодилатации, то объем должен восполняться через аортальную канюлю. Может развиться тяжелая легочная гипертензия.
Ведение после отключения АИК
- Обеспечить адекватную анестезию и анальгезию при помощи ингаляционных анестетиков (например, галотан/изофлюран) и опиоидов.
- Систолическое давление следует поддерживать между 80 и 140 мм рт. ст. тщательным восполнением и коррекцией при помощи инфузии нитроглицерина/адреналина по мере необходимости.
- Если у пациента сохраняется гипотензия или кровотечение, то необходимо сообщить хирургу прежде, чем будет закрыта грудная клетка.
Кардиоплегия
Обычно на основе крови или кристаллоида. Раствор, содержащий калий (20 ммоль/л), магний и прокаин, при быстром введении вызывает асистолию. В дальнейшем дозы повторно вводят каждые 20 мин или когда возобновляется электрическая активность. Преимущества кардиоплегии кровью в значительной степени теоретические и основаны на том, что гемоглобин несет кислород и таким образом уменьшает повреждение миокарда.
Реперфузионую кардиоплегию (теплой кровью) иногда используют к концу искусственного кровообращения чтобы вымыть продукты обмена веществ и создать кислородную «поддержку» миокарду. Обычно применяют антероградную кардиоплегию (через коронарные артерии), но можно проводить и ретроградную кардиоплегию через коронарный синус.
Температурный режим
В течение работы АИК можно позволить снижение температуры пациента до 34 °С, или активно охладить его до более низкой (28-34 °С) температуры. В целом, более низкая температура обеспечивает лучшую защиту мозга, а более высокая температура предпочтительна да сердца. Различные центры применяют разные подходы и методики гипотермии, часто оставляя ее для более сложных случаев.
Временное пережатие и фибрилляция
При вшивании трансплантатов коронарных артерий хирург может использовать как кардиоплегию (традиционно), так и временное пережатие с фибрилляцией. При временном пережатии аорту пережимают и помещают электрод фибриллятора под сердце. Когда сердце фибриллирует, потребность в кислороде уменьшена, и можно накладывать швы на дистальный конец трансплантата. После каждого трансплантата зажим снимают и восстанавливают синусовый ритм кардиоверсией. В это время верхний конец вшивают в аорту.
Преимущества состоят в том, что кардиоплегия не используется (следовательно, снижается возможность развития полной блокады сердца) и после того, как каждый трансплантат вшит, возможен ЭКГ-контроль с целью определения какой бы то ни было ишемии. Однако, поскольку сердце не защищено кардиоплегией, время операции должно сводиться к минимуму, чтобы избежать повреждения миокарда.
Контроль уровня калия
Для стабильности миокарда во время ИК важно поддерживать уровень калия в плазме между 4 и 5 ммоль/л. Гипокалиемия развивается часто и должна быть скорригирована дробным введением 20 ммоль KCl. Коррекцию предпочтительно проводить, пока продолжается ИК, таким образом, избегая необходимости вводить калий в центральную вену, непосредственно в нестабильный миокард.
Сравнение «Альфа-стат» и «pH-стат» режимов по газовому составу артериальной крови
Альфа-стат и pH-стат режимы отличаются в зависимости от того, поддерживаются ли РаСО2и pH в пределах нормальных значений при фактической температуре пациента или при 37 °С.
pH-стат: РаСО2 и pH поддерживаются около 5,0 кРа и 7,4 соответственно, при фактической температуре тела, процесс, называемый «температурной поправкой». Таким образом, во время гипотермии СО2 добавляется в АИК. Когда проводят измерение на газоанализаторе при 37 °С, это вызывает высокий уровень РаСО2 и низкий pH (подобно дыхательному ацидозу).
Альфа-стат: пытается копировать нормальную реакцию пойкилотермных животных, у которых РаСО2 во время гипотермии уменьшается в соответствии с температурой тела. При Альфа-стат значения РаСО2 не корректируются по уровню температуры и сохраняются в нормальном диапазоне, когда измерение проводят на газоанализаторе при 37 °С.
Когда эти два метода сравнили при проведении ИК с гипотермией до 28 °С, определили, что существует разница в уровнях РаСО2 в 3 кРа. Было показано, что этот градиент РаСО2 значительно изменяет мозговой кровоток, т. к. цереброваскулярная реактивность поддерживается углекислым газом.
Потенциально неблагоприятные эффекты pH-стат включают:
- повышенный мозговой кровоток, возможно, увеличивает эмболическую нагрузку на мозг (то есть воздух/обломки тканей);
- повышенный мозговой кровоток в неишемизированных областях может вызвать феномен обкрадывания;
- «дыхательный ацидоз» (повышенный уровень СО2) может нарушать нормальную функцию клеток.
Теоретические преимущества pH-стат включают.
- ацидоз — противодействует сдвигу кривой диссоциации кислорода влево, сопровождающему гипотермию, что усиливает высвобождение кислорода из гемоглобина,
- угнетение ферментативной активности, связанное с ацидозом, — может усиливать снижение общей метаболической активности, вызванной гипотермией.
Как видим, потенциально неблагоприятные эффекты pH-стат выглядят перевешивающими любые преимущества. Альфа-стат методика в настоящее время используется все чаще.
Ингаляционные анестетики и искусственное кровообращение
Галотан, изофлюран, энфлюран и севофлюран успешно используют в кардиоанестезии. Все они вызывают вазодилатацию, кардиодепрессию и брадикардию в зависимости от дозы. Изофлюран, как показали опыты на животных, вызывает феномен «обкрадывания», но убедительных данных за его проявления у человека нет.
Большое исследование в 1990-х представило в сравнении различные методы анестезии, использовавшиеся тогда в кардиохирургии, и предоставило выводы, что нет никакой разницы между используемыми анестетиками в их влиянии на осложнения или летальность.
Галотан — ингаляционный анестетик, применяемый дольше всех и, казалось, что совсем недавно разработанные ингаляционные анестетики (энфлюран, изофлюран или севофлюран) не будут иметь каких-либо преимущества по отношению к нему. Однако есть данные, что при повторной анестезии, случаи развития гепатита во время воздействия галотана могут быть чаще, по сравнению с другими средствами.
Расчет степени риска
Схему стратификации степени риска Парсоннета можно использовать для расчета риска и прогнозирования летальности у кардиохирургических пациентов. Однако ее следует использовать только для ориентировочного прогнозирования хирургического результата.
Женщина – 1 балл
Возраст
- 70-74 – 7 баллов
- >75 – 12 баллов
Фракция выброса
- Хорошая – 0 баллов
- Средняя (30-49%) – 2 балла
- Слабая (<30%) – 4 балла
Ожирение
- >1,5 идеального веса – 3 балла
Диабет – 3 балла
Гипертензия
- Систолическое давление > 140 мм рт. ст. – 3 балла
Реоперация
- Первая реоперация – 5 баллов
- Вторая и последующие реоперации – 10 баллов
Предоперационная интрааортальная баллонная контрапульсация
- Продолжается на операции – 2 балла
Аневризма левого желудочка – 5 баллов
Операция на клапанах: митральный
- Давление в легочной артерии <60 мм рт. ст. – 5 баллов
- Давление в легочной артерии >60 мм рт. ст. – 8 баллов
Операция на клапанах: аортальный
- Градиент <120 мм рт. ст. – 5 баллов
- Градиент >120 мм рт. ст. – 7 баллов
Клапан и АКШ – 2 балла
Экстренная операция после коронарной катетеризации – 10 баллов
Хрониодиализ – 10 баллов
Катастрофические ситуации – 10-50 баллов
Другие обстоятельства (астма и т. д.) – 2-10 баллов
Степень риска – Прогнозируемая летальность
- 0-4 балла – Минимальная – 1%
- 5-9 баллов – Низкая – 5%
- 10-14 баллов – Средняя – 9%
- 15-19 баллов – Высокая – 17%
>20 баллов – Крайне высокая – 31%
Традиционно операцию аортокоронарного шунтирования в прошлом выполняли на неработающем сердце в условиях подключения пациента к аппарату искусственного экстракорпорального кровообращения.

Аппарат искусственного кровообращения (АИК), или аппарат «искусственное сердце — легкие» — специальное медицинское оборудование, обеспечивающее жизнедеятельность человека при частичной или полной невозможности выполнения функций сердца и/или лёгких.
Данное устройство призвано обеспечивать кровообращение во всём организме в то время как сердце полностью выключается из кровотока, для того, чтобы хирургу было легче осуществить на нём все необходимые манипуляции.
При этом кровь пациента по трубочке поступает в аппарат искусственного кровообращения, где, как в лёгких, идёт процесс газообмена, вследствие которого кровь насыщается кислородом и затем вновь доставляется пациенту. Помимо этого, она дополнительно фильтруется, охлаждается либо согревается (то есть поддерживается её оптимальная температура).
Искусственное кровообращение не лишено своих недостатков, и способно отрицательно влиять на некоторые ткани и органы человека.
К числу побочных эффектов относят нарушения мозговой деятельности, свёртывающей системы крови, почечную недостаточность, воспалительные процесс, тенденцию к снижению когнитивного восприятия в постоперационный период.
В целях минимизации негативных последствий уже стали использовать центрифужный насос для крови, что обеспечивает менее травматичное управления кровотоком, а для уменьшения реакции взаимодействия крови больного с обширной чужеродной поверхностью систему для экстакорпорального кровообращения теперь делают с бисовместимым покрытием.
В последние годы благодаря совершенствованию хирургической и анестезиологической техники и модернизации медицинского оборудования стало возможным выполнять операцию аортокоронарного шунтирования на работающем сердце, обходясь без применения аппарата искусственного кровообращения.
Во время проведения хирургических вмешательств по шунтированию на бьющемся сердце деятельность его не нарушается. Врач накладывает эластичный шов впереди и позади зоны шунтирования и, таким образом, освобождает от крови область операции, чтобы достичь максимальной точности выполнения процедуры. В ряде случаев может потребоваться наложение коронарного шунта, чтобы перевести кровообращение в дистальную часть венечной артерии.
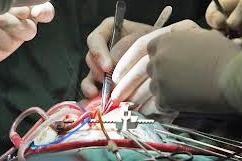
У таких операций на работающем сердце обнаружились существенные преимущества в связи со снижением среднего возраста кандидатов на шунтирование и повышенным числом сопутствующих соматических заболеваний.
Сейчас специалисты всего мира пришли к выводу, что данная тактика наиболее оптимальна для пациентов с диагностируемым атеросклерозом аорты и для лиц старше семидесяти пяти лет.
При наличии новоустановленной закупорки коронарных сосудов, при патологии деятельности сердца и почек эта тактика тоже считается более рациональной, так как от подключения к аппарату искусственного кровообращения здесь лучше воздержаться.
Относительно недавно было доказано, что коронарное шунтирование на бьющемся сердце снижает риск постоперационных осложнений у больных сахарным диабетом.
ПРОТИВОПОКАЗАНИЯ
Противопоказания, относительны и включают в себя ситуации, когда имеет место малый диаметр венечных артерий, коронарные сосуды проникают внутрь миокарда («мышечные мостики), отсутствует гемодинамический баланс или есть необходимость осуществлении дополнительной процедуры по типу протезирования сердечного клапана и др.
