Противовирусная терапия интерферонами побочные действия
АМИКСИН® — современное противовирусное и иммуностимулирующее средство; способствует образованию в организме четырех видов интерферонов (альфа, бета, гамма и лямбда).
Узнать подробнее про АМИКСИН®…
Противовирусные препараты с иммуностимулирующей активностью могут рекомендоваться как при лечении гриппа, так и других ОРВИ. С их помощью можно сократить сроки болезни и предотвратить развитие осложнений.
Узнать подробнее о препаратах…
Прием противовирусного препарата АМИКСИН® возможен на любой стадии простуды и гриппа по рекомендации врача.
Как принимать препарат?
В сезон простуды и гриппа прием противовирусных и иммуномодулирующих препаратов помогает снизить вероятность заболевания.
Узнать больше о профилактике…
АМИКСИН® — современный противовирусный и иммуномодулирующий препарат, используемый в комплексной терапии целого ряда вирусных инфекционных заболеваний, в том числе гриппа, ОРВИ и герпеса.
Подробнее о препарате…
Иммуномодулирующие препараты — одни из важных составляющих комплексной терапии гриппа и других ОРВИ.
Подробнее…
Справиться с вирусными инфекциями бывает очень сложно. Но в самом нашем организме есть «встроенная» система противовирусной защиты. Это специальные вещества, интерфероны. Чтобы помочь организму справиться с болезнью, медицина создала лекарственные препараты — искусственные интерфероны и стимуляторы их синтеза, о которых пойдет речь в этой статье.
Функции и механизм действия интерферона в человеческом организме
Интерферон — это белковая молекула, которая обеспечивает противовирусный иммунитет. При этом она обладает неспецифической активностью, то есть действуют не на возбудителя какого-то конкретного заболевания, а на все вирусные частицы в целом. Если сказать обобщенно, то интерферон — универсальный защитник организма, который начинает действовать еще до того, как в работу включатся остальные звенья иммунитета[1]. Препараты интерферона применяются даже в терапии онкологии: они подавляют опухолевый рост.
Клетки вырабатывают этот защитный белок в ответ на действие вирусов, бактерий, опухолевых клеток или продуктов их метаболизма. Стимулировать их выработку могут и лекарственные препараты — индукторы интерферона. Молекулы последних, попадая в кровь и межклеточную жидкость, связываются с рецепторами зараженных или поврежденных клеток. Они запускают сложный каскад реакций, приводящих к образованию специфических белков. В результате клетка перестает воспроизводить вирусные частицы, расщепляет их генетическую структуру, а поверхность этой клетки становится менее проницаемой для внутриклеточных паразитов.
Кроме действия на сами зараженные клетки, интерфероны стимулируют активность других звеньев иммунитета, контролируют воспалительную реакцию[2] и даже могут защитить организм от опухолей. Это свойство активно изучают и уже используют для борьбы с некоторыми видами рака[3].
Виды человеческого интерферона
Молекулы интерферона отличаются между собой по генетической структуре, типу клеточных рецепторов, на которые они действуют, даже по участкам ДНК, которые кодируют их состав. Все интерфероны делят на 3 типа.
- К первому типу относят альфа-интерферон, который имеет 13 различных структурных вариантов, а также бета-, каппа-, эпсилон- и омега-.
- Второй тип представлен только одним типом, гамма-интерфероном.
- Относительно недавно, в 2002 году, был открыт и третий тип молекул, лямбда-. Это отдельное семейство интерферонов, которое отличается от всех предыдущих генетическим строением и даже типом рецепторов, с которыми они взаимодействуют. Но по своей биологической активности лямбда-интерфероны очень похожи на первый тип[4].
Не стоит относиться к интерферонам как к панацее от всех бед. Во-первых, некоторые вирусы могут подавлять образование специфических белков внутри зараженных клеток, что значительно снижает эффективность противовирусной защиты.
Во-вторых, это лишь первая «линия обороны», которая стимулирует другие звенья иммунитета и временно приостанавливает продвижение «врага» по организму, давая время на выработку иммунных клеток и антител.
В-третьих, основной механизм действия интерферона — это подавление развития и деления. В физиологических дозах этот эффект контролирует размножение вирусов и опухолевых клеток. Но при введении значительных доз «чужеродного» вещества могут пострадать и собственные ткани организма, которые быстро обновляются. В первую очередь — клетки крови.
Поэтому прежде чем начинать лечение препаратами интерферона, нужно внимательно изучить пользу и возможный вред от их приема.
Применение аналогов интерферона в медицине
Лекарственные средства на основе интерферона доказали свою эффективность[5] в лечении широкого круга заболеваний: герпетических инфекций, ВПЧ, острых и хронических форм вирусного гепатита, рассеянного склероза, волчанки, гриппа и многих других вирусных и бактериальных инфекций. Применяют интерферон и при терапии онкологических заболеваний, а также СПИДа. И это притом, что по меркам медицины открыли его совсем недавно. Это произошло в 1957 году при проведении опытов на мышах. Ученые обратили внимание, что животные, заразившиеся одним вирусом, становились невосприимчивы к другому вирусному заболеванию. Это явление было названо интерференцией, а вещества, которые ему способствовали — интерферонами. Оказалось, что интерфероны вырабатываются не только у мышей, но и у всех млекопитающих, в том числе у человека. Началось изучение возможности промышленного производства веществ, обладающих противовирусным эффектом.
Однако долгое время применение интерферонов было ограничено из-за несовершенства процедуры их получения. Выделять это вещество из крови человека-донора было сложно, дорого и неэффективно.
Цифры и факты
В 1 литре крови донора содержится всего 1 мкг интерферонов. Примерно такое количество этих молекул нужно для того чтобы изготовить всего одну дозу препарата[6]. А за курс лечения тяжелых вирусных заболеваний, таких как гепатит, человек может получить около 150 доз[7].
В 1980 году в Японии впервые использовали для производства интерферона специально выращенную культуру лимфобластных клеток. А в 1981 году в США вместо клеток человека использовали культуру дрожжевых грибков. С помощью генной инженерии в геном ввели ген, который кодирует производство молекулы интерферона. Это позволило значительно упростить производство препарата[8].
По способу производства существует четыре основных разновидности этого препарата: лейкоцитарный, лимфобластоидный, рекомбинантный и пегилированный.
Лейкоцитарный интерферон получают из крови доноров. Для того чтобы усилить выработку нужных веществ, клетки предварительно стимулируют чаще всего с помощью непатогенных вирусов — таких частиц, которые не могут вызвать заболевание, но при этом воспринимаются клетками иммунной системы как «сигнальные».
После получения такой препарат очищают и концентрируют. В него могут входить все виды интерферонов и другие биологически активные вещества. Это одновременно и плюс, и минус. Преимущество такого препарата — его высокий потенциал биологического действия. Недостаток — высокая вероятность побочных эффектов при внутримышечном введении.
Лимфобластоидный интерферон получают не от человека-донора, а из культуры лимфобластных клеток, которые также обрабатывают веществами, стимулирующими иммунный ответ. Такие препараты содержат определенное соотношение различных видов интерферона и не так часто вызывают побочные эффекты.
Рекомбинантные препараты получают из культуры клеток бактерий или грибов, в которые специально внедрили участок человеческого гена. Интерферон, полученный таким образом, может немного отличаться по своему строению от «природного» человеческого. Такие препараты сохраняют противовирусную активность, но стимуляции иммунитета с их помощью добиться сложно[9].
Пегилированные, или ПЭГ-интерфероны — это рекомбинантные белковые молекулы, соединенные с полиэтиленгликолем. Такое соединение увеличило срок действия интерферона в организме.
К примеру
Если стандартный рекомбинантный интерферон при лечении вирусного гепатита C нужно вводить три раза в неделю, то пегилированный достаточно использовать один раз за то же время[10].
ПЭГ растворим в воде, не вступает в биологические реакции в организме и не вызывает иммунного ответа. При присоединении ПЭГ молекула интерферона значительно увеличивается в размерах. А это, в свою очередь, увеличивает период полувыведения препарата.
Препараты на основе интерферона: показания и противопоказания к их применению
Объединить интерфероны в однородные группы по методу получения, формам выпуска и показаниям не получится. Каждый препарат имеет свои особенности применения, эффективность при определенных заболеваниях. В зависимости от степени очистки и других факторов какие-то препараты с одним и тем же видом иммуноглобулина могут применяться только местно, а какие-то можно использовать в виде инъекций.
Например, такие препараты как «Инферон» и «Альфаферон» относят к группе лейкоцитарных интерферонов. При этом «Инферон»[11] согласно инструкции применяют внутримышечно при неуточненных вирусных заболеваниях и для иммунотерапии. «Альфаферон»[12] тоже вводят в мышцу, но при этом уже используют для лечения гепатита, микоза и даже некоторых онкологических заболеваний. А «Интерферон человеческий лейкоцитарный»[13] используют для местного применения, закапывания в нос и проведения ингаляций.
Поэтому при выборе препарата интерферона стоит ориентироваться не только на общую характеристику группы веществ, но в первую очередь на рекомендации врача и инструкцию по применению конкретного препарата.
Интерферон в виде инъекций применяют при системных заболеваниях, таких как гепатит, опухоли или рассеянный склероз. Препарат в виде капель в нос подходит для лечения риносинуситов и профилактики ОРВИ. Капли в глаза помогут при конъюнктивите. Суппозитории можно использовать при многих заболеваниях, в том числе у детей. А гель подходит для смазывания носа или кожи.
Одной из наиболее однородных групп на сегодняшний момент являются пегилированные интерфероны. Существует два основных класса препаратов с доказанной эффективностью[14] — это пегинтерферон альфа-2а и пегинтерферон альфа-2b. Представитель первого класса — «Пегасис»[15], второго — «ПегИнтрон»[16]. Оба препарата используют подкожно, один раз в неделю и применяют только для лечения хронического вирусного гепатита В и С.
Рекомбинантный интерферон — одна из самых многочисленных по торговым наименованиям групп препаратов.[17] Сюда относятся такие лекарства как «Реаферон», «Виферон», «Ингарон», «Интерфераль» и другие. Эти препараты имеют различные формы для местного применения и для инъекций. У каждого препарата в инструкции определен свой перечень показаний, но в целом — это вирусные и бактериальные инфекции.
Интерфероны защищают организм от вирусов, бактерий и опухолевых клеток. Они обладают сложным биологическим действием. Но современная медицина научилась создавать аналогичные вещества и использовать их. Однако подбор подходящего препарата — задача, которую может решить только врач.
 Международные исследования и клиническая практика показали, что в настоящее время при проведении противовирусной терапии (ПВТ) наиболее оправдало себя сочетание двух препаратов — интерферона-альфа и рибавирина (комбинированная ПВТ). Каждый в отдельности из этих препаратов менее эффективны. C 2011 – 2012 года для пациентов с генотипом вируса 1 к этой схеме будет добавляться третий компонент — ингибитор протеазы, который позволит существенно улучшить эффективность и снизить длительность лечения. Каких-либо других способов лечения с доказанной эффективностью, способных обеспечить элиминацию вируса гепатита С, сегодня не существует. Основной задачей противовирусной терапии является профилактика цирроза печени и ГЦК. Цель лечения — достижение устойчивого вирусологического ответа (УВО) — отсутствие виремии (неопределяемый уровень РНК вируса в крови) через 24 недели после окончания лечения. При этом нормализуются все биохимические показатели крови, улучшается гистология печени. Долгосрочные наблюдения показали, что у большинства пациентов, достигших УВО, вирус далее не обнаруживается.
Международные исследования и клиническая практика показали, что в настоящее время при проведении противовирусной терапии (ПВТ) наиболее оправдало себя сочетание двух препаратов — интерферона-альфа и рибавирина (комбинированная ПВТ). Каждый в отдельности из этих препаратов менее эффективны. C 2011 – 2012 года для пациентов с генотипом вируса 1 к этой схеме будет добавляться третий компонент — ингибитор протеазы, который позволит существенно улучшить эффективность и снизить длительность лечения. Каких-либо других способов лечения с доказанной эффективностью, способных обеспечить элиминацию вируса гепатита С, сегодня не существует. Основной задачей противовирусной терапии является профилактика цирроза печени и ГЦК. Цель лечения — достижение устойчивого вирусологического ответа (УВО) — отсутствие виремии (неопределяемый уровень РНК вируса в крови) через 24 недели после окончания лечения. При этом нормализуются все биохимические показатели крови, улучшается гистология печени. Долгосрочные наблюдения показали, что у большинства пациентов, достигших УВО, вирус далее не обнаруживается.
Противовирусная терапия – единственный способ лечения гепатита С. Длительность терапии зависит от генотипа вируса, схемы лечения и динамики снижения концентрации вируса
Факторы, влияющие на успех лечения
Для успешного лечения крайне важно подобрать дозировку препаратов, длительность терапии, а также схему лечения.
Дозировка препаратов.
Дозировка препаратов различна для каждого из противовирусных средств и зависит от ряда факторов (масса тела, генотип вируса и др.)
Пегинтерфероны
ПегИнтрон® назначается из расчета 1,5 мг на 1 кг массы тела/неделю. Доза рибавирина рассчитывается исходя из массы тела: менее 65 кг – 800 мг/сутки, 65–85 кг – 1000 мг/сутки, 86–105 кг – 1200 мг/сутки, более 105 кг – 1400 мг/сутки.
Пегасис® назначается в дозе 180мкг, вне зависимости от массы тела. При возникновении серьезных побочных реакций возможна модификация дозы до 135 мкг, а в особых случаях – до 90 мкг или 45 мкг. Доза рибавирина составляет 1000 мг/сутки для пациентов с массой тела до 75 кг и 1200 мг/сутки при ее величине более 75 кг для генотипов 1 и 4 и 800 мг (независимо от массы тела) для генотипа 2 и 3.
Простые (короткоживущие) интерфероны
Дозировка простых интерферонов составляет 3-6 миллионов единиц, трижды в неделю (через день). Вводятся простые интерфероны внутримышечно или подкожно. Эффективность лечения этими интерферонами ниже, чем при применении комбинации пегилированного интерферона и рибавирина, поэтому в некоторых случаях назначают ежедневное введение (решение принимает лечащий врач). Дозировка рибавирина рассчитывается исходя из массы тела больного: при массе тела ≤75 кг дозировка рибавирина составляет 1000мг, а при массе >75 – 1200мг.
Длительность терапии
Сроки лечения ХВГС находятся в пределах 16 – 72 недель. Оптимальная продолжительность лечения зависит от генотипа вируса гепатита С: при инфицировании 1-м генотипом она составляет 48 недель, при 2-м и 3-м – 24 недели. Длительность лечения может быть сокращена с 24 до 16 недель для генотипов 2 и 3 или с 48 до 24 недель для генотипов 1 и 4 (возможность сокращения продолжительности лечения до 24 недель у пациентов с 1 и 4 генотипом вируса и быстрым вирусологическим ответом через 4 недели лечения при исходно низкой вирусной нагрузке, отсутствии выраженного фиброза печени и применении пегинтерферонов). С другой стороны, длительность терапии может быть увеличена, в зависимости от промежуточных результатов лечения до 72 недель (у пациентов с частичным РВО [снижение уровня РНК HCV на 2 и более десятичных логарифма к 12 неделе лечения], с ко-инфекцией ВИЧ и с продвинутым фиброзом печени.) Изменение сроков лечения и дозировки препаратов, в зависимости от промежуточных результатов называется «ответориентированной терапией» или терапией, управляемой вирусологическим ответом. Терапия, управляемая вирусологическим ответом, позволяет индивидуализировать лечение для каждого конкретного пациента, определяет длительность терапии в зависимости от вирусной нагрузки пациента на исходном уровне и наличия вирусологического ответа во время проведения терапии, оптимизируя лечение.
Схемы противовирусной терапии
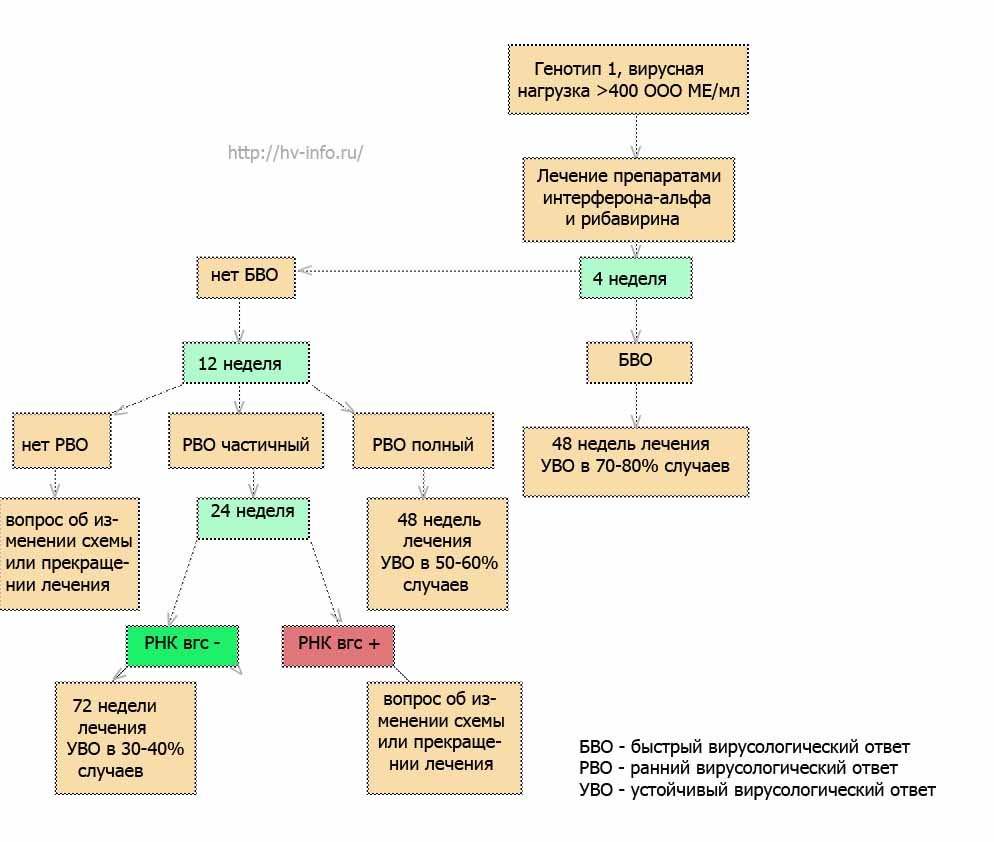
Схему лечения разрабатывает лечащий врач, учитывая Ваши исходные данные и особенности течения заболевания. На рисунках 1, 2 и 3 приведены самые распространенные схемы ПВТ для генотипов 2, 3 и 4.
.jpg)
Рис.1 Схема противовирусной терапии для генотипа 1 и низкой (менее 400000ME/Мл) вирусной нагрузке.

Рис.2 Схема противовирусной терапии для генотипа 1 и высокой (более 400000ME/Мл) вирусной нагрузке.
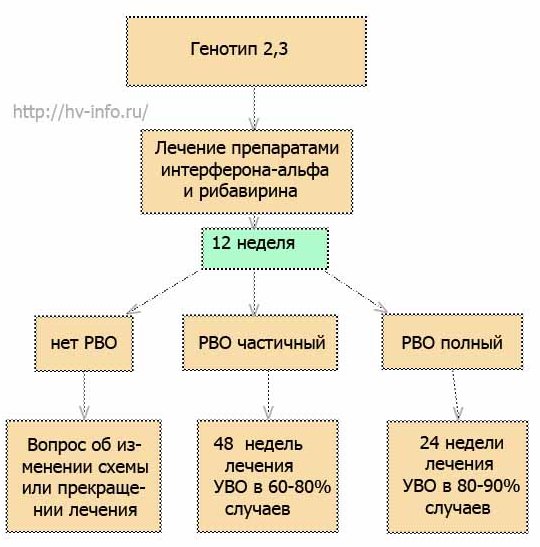
Рис.3 Схема противовирусной терапии для генотипов 2 и 3.
У кого лучшие шансы на успешное лечение?
Предикторы ответа на противовирусное лечение ХГС
• генотип вируса не 1
• вирусная нагрузка менее 600 000 МЕ/мл
• пол женский
• возраст моложе 40 лет
• масса тела менее 75 кг
• отсутствие резистентности к инсулину
• повышенная активность трансаминаз
• отсутствие выраженного фиброза или цирроза по данным морфологического исследования печени.
Какие анализы делать во время терапии?
Развитие побочных эффектов контролируется при каждом визите к врачу. Необходимо регулярно проводить лабораторную диагностику (общий анализ крови, уровень гормонов щитовидной железы и др.) В таблице 1 приведены лабораторные показатели, требующие регулярного контроля.
Таблица 1. Контроль анализов во время противовирусной терапии
| Параметр | Интервал | Комментарии |
| Лейкоциты, Hb , тромбоциты, клиренс креатинина | До лечения, 1 или 2 неделя, 4 неделя, затем ежемесячно или 2 раза в месяц во время лечения, или чаще при показаниях | До лечения указанные параметры должны составлять: Hb ≥ 12 г/дл для мужчин и ≥ 11 г/дл для женщин; абсолютное число нейтрофилов > 1,5 ×109/л, тромбоцитов > 70 ×109/л, клиренс креатинина > 50 мл/мин. |
| Билирубин общий и фракции АсАТ АлАТ | До лечения, 1 месяц, затем каждые 1-2 мес. | Кратность исследования может определяться индивидуально в зависимости от предшествующих показателей, течения заболевания, наличия цирроза и сопутствующих болезней |
| Аутоантитела, Тиреотропный гормон (ТТГ) | До лечения и минимум один раз в 3 месяца во время лечения | При повышении уровня ТТГ необходимо подтвердить результат и определить уровень свободного тироксина (Т4). При необходимости показана заместительная терапия тироксином. При измененных показателях аутоантител кратность исследования индивидуальная в зависимости от предшествующих показателей |
| Глюкоза крови | До лечения и минимум один раз в 3 месяца во время лечения | При повышении уровня глюкозы подтвердите результат путем определения уровня гликозилированного Hb. При его повышении показано назначение препаратов, снижающих инсулинорезистентность тканей. |
| РНК ВГС (количественный и/или качественный метод определения) | До лечения, 4, 12 и 24 неделя во время терапии, в конце лечения, через 6 месяцев после ее завершения | Необходимо рассмотреть возможность прекращения лечения, если на 12 неделе отмечается снижение уровня РНК ВГС менее 2 log10. Если ранний вирусологический ответ не достигнут и лечение продолжено, терапию следует прекратить, если РНК ВГС определяется на 24 неделе в том случае, если целью терапии является эрадикация вируса. |
| Обследование на наличие депрессии | До лечения и при каждом визите | При выявлении депрессии показано назначение антидепрессантов и/или направление к психиатру |
Как узнать, что лечение действует?
Ответ на лечение может быть измерен по биохимическим показателям — нормализация уровня сывороточной АЛТ (биохимический ответ), по вирусологическим параметрам — снижение уровня РНК ВГС (вирусологический ответ) и гистологическим критериям — уменьшение выраженности воспалительных явлений в печени или фиброза по данным биопсии печени, проведенной после лечения). Вирусологический ответ является наиболее общепринятым методом оценки эффективности лечения ХГС. Биохимический и вирусологический ответ обычно ассоциируются с улучшением гистологической картины. Учитывая инвазивность биопсии печени, в повседневной практике после окончания лечения не рекомендуется повторное ее проведение.
Таблица 2. Критерии эффективности противовирусного лечения
| Вирусологический ответ | Определение | Клиническое значение |
| Быстрый вирусологический ответ (БВО) | РНК HCV исчезает через 4 нед от начала лечения | Имеет позитивное прогностическое значение в плане стабильного вирусологического ответа. Пациенты с 1-м и 4-м генотипами вируса, достигшие БВО, могут получать более короткий курс лечения – 24 нед. При 2-м и 3-м генотипах курс терапии также может быть сокращен (до 12–16 нед). При этом повышаются риски развития рецидива гепатита. Отсутствие БВО не должно служить основанием для прекращения лечения |
| Ранний вирусологический ответ (РВО) | Снижение уровня РНК HCV на 2 и более десятичных логарифма (частичный РВО) или исчезновение РНК HCV из крови через 12 нед от начала лечения (полный РВО) | Предиктор устойчивого вирусологического ответа. Отсутствие РВО у больных с 1-м генотипом с высокой вероятностью свидетельствует о том, что такой пациент не достигнет устойчивого вирусологического ответа. Лечение может быть прекращено. Удлинение курса лечения до 72 нед оправдано у больных с частичным РВО. При инфицировании 2-м и 3-м генотипами значение РВО несущественно, поскольку у большинства пациентов вирус элиминируется к 12-й неделе |
| Ответ на момент окончания лечения | РНК HCV не определяется через 24 или 48 нед лечения | Не используется для прогноза устойчивого ответа на лечение, но необходим для его достижения |
| Вирусологический прорыв | Повторное появление РНК HCV в крови до окончания лечения | Повторный курс терапии Пег-ИФН с рибавирином рассматривается только для больных, которые прежде лечились «коротким» ИФН (с/без рибавирина) |
| Рецидив | Повторное появление РНК HCV в крови после окончания лечения | Повторный курс терапии Пег-ИФН с рибавирином рассматривается только для больных, которые прежде лечились «коротким» ИФН (с/без рибавирина) |
| Вирусологический ответ отсутствует | Продолжающееся выявление РНК HCV в сыворотке крови через 24 нед лечения или снижение уровня РНК HCV менее чем на 2 десятичных логарифма спустя 12 нед от начала лечения | Повторная терапия больных, получивших комбинированный курс Пег-ИФН с рибавирином, не рекомендуется. Повышение дозы Пег-ИФН (до 3 мгк/кг/нед) не сопровождается значительным возрастанием эффективности лечения в сравнении со стандартной дозой (1,5 мкг/кг/нед) Применение высоких доз рибавирина (1600–3600 мг/ сут) лимитируется развитием выраженных побочных эффектов (анемия) и не может быть рекомендовано |
Существует большая вероятность достижения УВО при достижении ранней вирусной супрессии, чем при замедленном или неполном вирусологическом ответе на лечение. Быстрый и ранний вирусологические ответы могут рассматриваться в качестве предикторов устойчивого вирусологического ответа. При достижении РВО у ранее нелеченых пациентов вероятность достижения УВО составляет 65-76%. При отсутствии достижения РВО вероятность получения УВО составляет ≤ 3%. В таком случае необходимо прекратить лечение. При отсутствии достижения РВО решение о прекращении лечения должно быть принято после всестороннего рассмотрения любого вирусологического ответа, переносимости лечения и существующего поражения печени.
В процессе лечения, в связи с побочными явлениями, зачастую приходиться корректировать дозу препаратов.
Что делать, если снизились гематологические показатели?
При проведении противовирусной терапии необходимо регулярно проверять уровень лейкоцитов крови и определять абсолютное количество нейтрофилов (АЧН). Помочь самим подсчитывать и контролировать АЧН Вам поможет статья «Нейтропения и проведение противовирусной терапии интерфероном». Также в общем анализе крови нужно проверять уровень тромбоцитов и гемоглобина. При достижении критических значений требуется модификация дозы или отмена препаратов.
Таблица 3. Рекомендации по коррекции дозы интерферона на ПВТ
| Лабораторные значения | Рекомендации по коррекции дозы препарата |
| Лейкоциты < 1,5 × 109/л | Снижение дозы интерферона альфа на 50% и повторное определение количества лейкоцитов |
| < 1 × 109/л | Отмена интерферона альфа до восстановления количества лейкоцитов |
| абсолютное число нейтрофилов* < 0,75 × 109/л | Интерферон альфа: снижение дозы на 50% и повторное определение количества нейтрофилов |
| < 0,50 × 109/л | Отмена интерферона альфа до восстановления количества нейтрофилов |
| Тромбоциты** < 80 × 109/л | Интерферон альфа-2b: снижение дозы на 50% и повторное определение количества тромбоцитов |
| < 50 × 109/л | Интерферон альфа-2а: снижение дозы и повторное определение количества тромбоцитов Отмена интерферона альфа-2b до восстановления количества тромбоцитов |
* Если доза поддерживается не по рекомендациям производителя, необходимо чаще определять абсолютное число нейтрофилов и проконсультировать пациентов о последствиях нейтропении. У пациентов с циррозом печени, после трансплантации печени, с ко-инфекцией ВИЧ/ВГС при сохранении нейтропении, несмотря на снижение дозы, необходимо назначить гранулоцитарный колониестимулирующий фактор. | |
Таблица 4. Рекомендации по коррекции дозы рибавирина
| Параметр | Рекомендации |
| Гемоглобин 10 г/дл | При минимальных симптомах снижение дозы не требуется. При наличии симптомов, дозу рибавирина следует уменьшить на 200 мг/сутки и/или назначить эритропоэтин |
| 8,5 г/дл | Снижение дозы рибавирина на 200 мг/сутки и/или назначение эритропоэтина Следует повторно определять уровень гемоглобина каждые 2 недели или при необходимости чаще |
| < 8,5 г/дл | Отмена рибавирина до восстановления уровня гемоглобина |
Примечание. 1. При стабильном заболевании сердца необходимо уменьшить дозу рибавирина на 200 мг/сутки при снижении уровня гемоглобина ≥ 2 г/дл в течение 4 недель. | |
Важно помнить, что противовирусную терапию должен проводить опытный врач. Не используйте эту информацию для самостоятельной диагностики и лечения. Это может привести к развитию необратимых побочных эффектов.
Советуем почитать:
Обновленные данные по лечению хронического вирусного гепатита С генотипа 1
